下列是模拟石油深加工来合成CH2=CHCOOCH2CH3(丙烯酸乙酯)等物质的过程: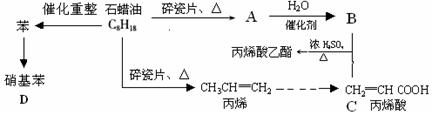
请回答下列问题:
(1)A的结构简式为:
(2)CH2=CHCOOCH2CH3的含氧官能团 (填名称)
(3)写出下列化学反应方程式
①B+C→CH2=CHCOOCH2CH3:
②丙烯→聚丙烯:
③苯→硝基苯如何加热?: 。其优点是 。
(4)目前制备酒精的方法有两种:
方法一: 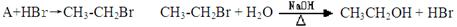
方法二: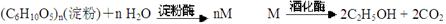
①对方法一所涉及的有机反应类型分别为: ,
②对于方法二, M的分子式为:
③下列说法正确的是____________(填代号)
A、从绿色化学的角度看方法一的原子利用率100%
B、从原料的可再生性来说,方法二最好
C、方法二产物乙醇储藏的化学能来自于太阳能
(11分)测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示.
(1)写出该反应的热化学方程式(中和热为57.3 kJ/mol):;
(2) 装置图中碎泡沫塑料所起作用为:;
(3) ①取50 mL NaOH溶液和30 mL硫酸溶液进行实验,
实验数据如下表.请填写下表中的空白:
| 温度 实验次数 |
起始温度T1/℃ |
终止温度T2/℃ |
温度差平均值(T2-T1)/℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
30.1 |
________ |
| 2 |
27.0 |
27.4 |
27.2 |
33.3 |
|
| 3 |
25.9 |
25.9 |
25.9 |
29.8 |
|
| 4 |
26.4 |
26.2 |
26.3 |
30.4 |
②若上述实验所测中和热数值偏小,产生偏差的原因可能是()
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
钾是一种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:Na(l)+ KCl(l) NaCl(l)+ K(g) ΔH>0 该反应的平衡常数可表示为:K =" C(K)" 各物质的沸点与压强的关系见下表。
NaCl(l)+ K(g) ΔH>0 该反应的平衡常数可表示为:K =" C(K)" 各物质的沸点与压强的关系见下表。
| 压强(kPa) |
13.33 |
53.32 |
101.3 |
| K的沸点(℃ ) |
590 |
710 |
770 |
| Na的沸点(℃ ) |
700 |
830 |
890 |
| KCl的沸点(℃ ) |
1437 |
||
| NaCl的沸点(℃ ) |
1465 |
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为,而反应的最高温度应低于;
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是(任写一条);(3)常压下,当反应温度升高至 900℃ 时,该反应的平衡常数可表示为:K =。
用18 mol/L H2SO4配制90 mL 1.0mol/L H2SO4,若实验仪器有A.100m L 量筒 B.托盘天平 C.
玻璃棒 D.50m L容量瓶 E.10m L量筒 F.胶头滴管 G.50m L烧杯 H.100m L 容量瓶 I.5ml量筒
(Ⅰ)实验时选用的仪器有(填序号)_______________ 。配制过程中,下列情况会使配制结果偏高的是 (填序号)_______。
容时俯视刻度线观察液面 ②容量瓶使用时未干燥 ③定容后经振荡、摇匀、静置,发现液
面低于刻度线,再加蒸馏水补至刻度
(Ⅱ)在容量瓶使用方法中,下列操作不正确的是(填序号)_______________
A.使用容量瓶前检查它是否漏水。
B.容量瓶用蒸馏水洗净后,再用待配液润洗。
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2㎝处,再改用胶头滴管加蒸馏水到刻度线。
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2㎝处,再改用胶头滴管加蒸馏水到刻度线。
E.定容后,盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转、摇匀。
F. 如配制100mL 0.200mol/L的氯化钠溶液时,可将称量的氯化钠固体溶于100mL蒸馏水中。
(1)等质量的O2、CH4、H2的物质的量的比值为_。
(2)38g某二价金属氯化物(ACl2)中含有0.8mol Cl-,则ACl2的摩尔质量是________;A的相对原子质量是____________;ACl2的化学式是__________。
新制备的氯水显__________色,说明氯水中有__________(填分子式)分子存在。
(4)向氯水中滴加几滴AgNO3溶液,立即有__________生成,说明氯水中有__________(填离子符号)存在,反应的化学方程式为________________氯水光照后颜色变浅,并放出_____气体。
已知NO2和N2O4可以相互转化:N2O4(g)  2NO2(g) △H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,各物质浓度随时间变化关系如下图所示:
2NO2(g) △H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,各物质浓度随时间变化关系如下图所示:
(1)图中共有两条曲线X和Y,其中表示N2O4浓度随时间变化的曲线是_________
(2)前10min内,v(N2O4)= ______________;
(3)a、b、c、d四个点中,表示化学反应处于平衡状态的是____,此时反应的平衡常数为______________(只要求写数值)
(4)反应进行到25min时,曲线发生变化的原因是____________________________;
若要达到最后相同的化学平衡状态,在25min时还可以采取的措施是()(双选)
| A.升高温度 | B.缩小容器体积 | C.加入催化剂 | D.加入一定量的N2O4 |