A、B、C、D 4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C。
(1)B元素的名称为___________;B在周期表中的位置是第___________周期第___________族。
(2)C的元素符号为______________,C的最高价氧化物的化学式为__________________。
(3)D的最高价氧化物对应的水化物的化学式为______________。
下列物质属于电解质的是;能导电的物质是。
①氨水②蔗糖③烧碱④NH3·H2O⑤CO2⑥铜
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是
(2)除去KNO3溶液中的I2杂质,主要操作步骤是:加CCl4后,振荡,静置,。水溶液最终从分液漏斗的分离出来
(3)黑火药是中国的“四大发明”之一。黑火药在发生爆炸时,发生如下的反应:
2KNO3+C+S=K2S+2NO2↑+CO2↑。其中被氧化的元素是,氧化剂是,生成1molCO2时转移的电子数目为(NA表示阿伏伽德罗常数的值)
硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化荆和催化剂等。
工业制硫酸铜的方法很多。
(1)方法一、用浓硫酸和铜制取硫酸铜。该反应的化学方程式是_____________________,此法的最大缺点是____________________________。
(2)方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:
①稀硫酸、铜和氧化铁反应的离子方程式是__________________、________________;
向混合溶液中通入热空气的反应的离子方程式是_______________________________。
②请说出调整PH为4的目的是_______________________;由滤液得到无水硫酸铜的实验操作是______________________________。
氯气在生产生活中应用广泛。实验室可用MnO2与浓盐酸反应制取,反应原理如下:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)若制得标准状况下11.2 L Cl2,则被氧化的HCl为___________mol。
(2)多余的氯气可用NaOH溶液吸收,反应的离子方程式为__________。
(3)海底蕴藏着丰富的锰结核矿,其主要成分是MnO2。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如下图所示:
①步骤Ⅰ中, 试剂甲必须具有的性质是____________(填序号)。
A.氧化性B.还原性C.酸性
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050 mol MnO2时,消耗0.10 mol·L-1的NaClO3溶液200 mL,该反应的离子方程式为___________________________。
(4)用100mL12.0 mol·L-1的浓盐酸与足量MnO2混合后,加热,反应产生的氯气物质的量远远少于0.30 mol,请你分析可能的原因为___________________________。
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O,工艺流程如下(部分操作和条件略):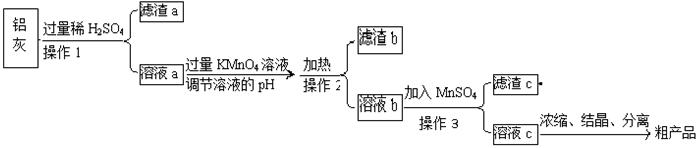
(1)滤渣a可用于制造。
(2)请将MnO4-氧化Fe2+的离子方程式补充完整: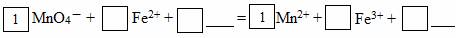
若反应中转移了2mol电子,则消耗氧化剂的物质的量为mol。
(3)已知生成氢氧化物沉淀的pH如下:
| Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
|
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
调节溶液pH约为3的目的是:。
(4)取少量滤渣C于试管中,加入适量的双氧水,产生能使带火星小木条复燃的气体,说明滤渣C的主要成分是。请写出加入MnSO4时所发生反应的离子方程式:。
(5)A12(SO4)3·18H2O溶于水溶液呈酸性的原因:。(用离子方程式表示)