按要求填写下列空白
(1)含有一个手性碳原子且式量最小的单烯烃的结构简式 。
(2)若分子式为C4H6的某烃中所有的碳原子都在同一直线上,则该烃的结构简式 _。
(3)烯烃A是2-丁烯的一种同分异构体,它在催化剂作用下与氢气反应的产物不是正丁烷,则A的结构简式为 。
(4)不能使酸性高锰酸钾溶液褪色的相对分子质量最小的苯的同系物的结构简式 _。
化学中的某些元素是与生命活动密不可分的元素。请回答下列问题:
(1)NH4NO3是一种重要的化学肥料,其中N原子的杂化方式分别是________,NO3—的空间构型为____________。
(2)A、B、C三元素的原子序数依次增大,它们原子的最外层电子排布均为4s1。
①B元素基态原子电子排布式为___________________________________________。
②A元素单质的晶体堆积模型为________(填字母),其空间利用率为__________。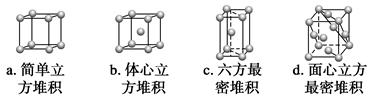
③氢元素与C元素可形成一种红色化合物,其晶体结构单元如下图。则该化合物的化学式为__________(小白球表示H,小黑球表示C)。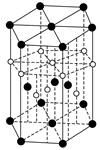
(3)已知氮化硼(BN)的一种晶体结构与金刚石相似,则B—N—B之间的夹角是________,氮化硼的密度为3.52 g·cm-3,则B—N键的键长是________pm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
铜及其合金是人类最早使用的金属材料。
(1)金属铜采取下列哪种方式堆积( )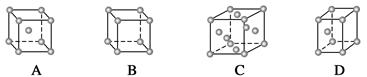
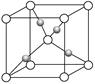
(2)在1个Cu2O晶胞中(结构如上图所示),Cu原子配位数为__________。
(3)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下: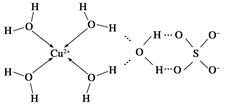
①胆矾的化学式用配合物的形式表示为____________。
②胆矾中SO42—的空间构型为________,H2O中O原子的杂化类型为________。
③某兴趣小组称取2.500 g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图。下列说法正确的是( )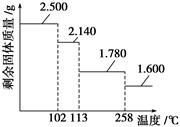
| A.晶体从常温升到105 ℃的过程中只有氢键断裂 |
| B.胆矾晶体中形成配位键的4个水分子同时失去 |
| C.120 ℃时,剩余固体的化学式是CuSO4·H2O |
| D.按胆矾晶体失水时所克服的作用力大小不同,晶体中的水分子可以分为3种 |
一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①写出基态Mn原子的价电子排布式为____________________________________。
②CO32—的空间构型是__________________(用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化为CO2,HCHO被氧化为CO2和H2O。
①根据等电子体原理,CO分子的结构式为_________________________________。
②CO2分子中C原子轨道的杂化类型为____________________________________。
③1 mol甲醛(HCHO)分子中含有的σ键数目为______________________________。
(3)向CuSO4溶液中加入过量NH3·H2O溶液可生成[Cu(NH3)4]2+。不考虑空间构型,[Cu(NH3)4]2+的结构可用示意图表示为______________________。
氯酸镁晶体[Mg(ClO3)2·6H2O]可用作棉花收获前脱叶剂、小麦催熟剂、除草剂、干燥剂。实验室制备少量Mg(ClO3)2的操作步骤如下:
(1)制备NaClO3晶体:在实验室里可用如图所示装置制取NaClO3。图中:a为氯气发生装置;b为NaClO3的制备装置;c为尾气吸收装置。
①装置a中反应的离子方程式为____________________________
②工业上用石灰乳代替烧碱溶液吸收尾气的原因是___________________________
③装置b中发生反应的化学方程式为3Cl2+6NaOH 5NaCl+NaClO3+3H2O,请推测在加热NaClO溶液时发生反应的化学方程式:______________________________。
5NaCl+NaClO3+3H2O,请推测在加热NaClO溶液时发生反应的化学方程式:______________________________。
(2)制备氯酸镁晶体:由上述提纯制得的NaClO3和MgCl2按化学反应方程式计量数之比混合可制得Mg(ClO3)2,原理为MgCl2+2NaClO3=Mg(ClO3)2+2NaCl。已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
请补充由(1)制得的NaClO3制备Mg(ClO3)2·6H2O的操作步骤:
①按计量数之比将MgCl2和NaClO3混合溶于85 ℃的热水中,加热蒸发;
②______________________;
③______________________;
④重结晶。
(3)问题讨论:①用60 ℃ Na2CO3溶液吸收Cl2也可制得NaClO3,请写出该反应的化学方程式:__________________________________________。
②制备氯酸镁晶体时最后进行重结晶操作的目的是___________________________。
氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:

提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
回答下列问题:
(1)反应②中除掉的杂质离子是__________,发生反应的离子方程式为__________;在加高锰酸钾溶液前,若pH较低,对除杂的影响是________________。
(2)反应③的反应类型为____________,过滤得到的滤渣中,除了过量的锌外还有______________。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是________________。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2,取干燥后的滤饼11.2 g,煅烧后可得到产品8.1 g,则x等于__________。