碱式碳酸铜和氯气都是用途广泛的化工原料。
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl−)制备碱式碳酸铜,其制备过程如下: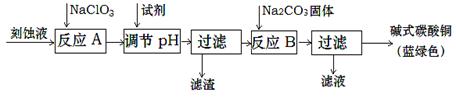
已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 |
Cu(OH)2 |
Fe (OH)2 |
Fe (OH)3 |
| 开始沉淀pH |
4.2 |
5.8 |
1.2 |
| 完全沉淀pH |
6.7 |
8.3 |
3.2 |
①氯酸钠的作用是 ;
②反应A后调节溶液的pH范围应为 。
③第一次过滤得到的产品洗涤时,如何判断已经洗净? 。
④造成蓝绿色产品中混有CuO杂质的原因是 。
(2)某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。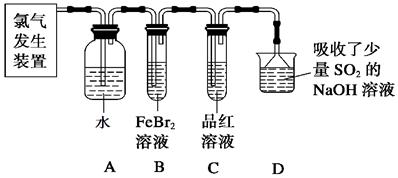
①实验室用二氧化锰和浓盐酸加热制取氯气,所用仪器需要检漏的有 。
②若C中品红溶液褪色,能否证明氯气与水反应的产物有漂白性,说明原因 。此时B装置中发生反应的离子方程式是___________ _____。
③写出A溶液中具有强氧化性微粒的化学式 。若向A溶液中加入NaHCO3粉末,会观察到的现象是 。
(7分)黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用做食盐添加剂(抗结剂),我国卫生部规定食盐中黄血盐的最大使用量为10mg·kgˉ1。黄血盐易溶于水,在水溶液中会电离出K+和[Fe(CN)6]4ˉ,其中CNˉ的电子式为 。它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O
。它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
(1)上述反应是否为氧化还原反应?______ (填“是”或“不是”)。
(2)食盐经长时间火炒,“亚铁氰化钾”名称前的“亚铁”就去掉了,变成了剧毒物质氰化钾,这是因为黄血盐在超过4000C时会分解,试配平该反应的化学方程式:
(3) 黄血盐可与高锰酸钾溶液反应,其化学方程式为
K4Fe(CN)6+ KMnO4+ H2SO4→KHSO4+ F e2(SO4)3+MnSO4+HNO3+CO2↑+H2O(未配平)
e2(SO4)3+MnSO4+HNO3+CO2↑+H2O(未配平)
①该反应的氧化产物有______(填化学式 )。
)。
②若有1mol K4Fe(CN)6被高锰酸钾氧化,则消耗高锰酸钾的物质的量为______mol。
水是生命之源,也是化学反应中的主角。请回答下列问题:(下列问题
所涉及的答案可能有多种,只需答出一种情况即可)
I.水是一种电解质,发生电离会产生电子总数相同的两种微粒,其电离的方程式为
Ⅱ.有以下五组离子① K+、Cl-、NO3-、S2-;② K+、Fe2+、I-、SO42-;③ Na+、Cl-、
NO3-、SO42-;④Na+、Ca2+、Cl-、HCO3-;⑤ K+、Ba2+、Cl-、NO3-。在由水电离产生的
K+、Ba2+、Cl-、NO3-。在由水电离产生的
c(OHˉ)= 1×10ˉ13mol/L溶液中,一定不能大量共存的离子组是(填序号)
Ⅲ. 在许多反应中H2O扮演不同的“角色”。请结合所学完成下列反应
(1)H2O参与的置换反应:
符合X+W→Y+V,已知X和Y分别是短周期同主族两种元素形成的单质, W、V是化合物
①W是水,离子方程式为;
②V是水,化学方程式为。
(2)水既不是氧化剂也不是还原剂的氧化还原反应:
A、B是中学化学常见的两种由短周期元素组成的有色气体,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,写出A、B与水反应的化学方程式:
①A + H2O;
②B + H2O;
(6分) A、B、C分别是硫酸、盐酸、硝酸钡三种溶液中的一种,将它们按一定顺序滴入到碳酸钠溶液中至恰好完全反应,有以下现象?
(1)加入A时生成白色沉淀.
(2)向(1)中沉淀加入B时,沉淀溶解,并有气体逸出.
(3)向(2)中生 成溶液里加入C时,又有白色沉淀生成.
成溶液里加入C时,又有白色沉淀生成.
根据以上事实判断,A是C是(写化学式),并写出(2) (3)反应的离子方程式.________________ _______________________________________________
在MnO2 + 4HCl (浓)△="==" MnCl2 + Cl2↑+ 2H2O的反应中,用“双线桥法”表示氧化还原反应中电子转移情况;还原剂是________,氧化产物是______,该反应的离子方程式为____________________________________________
(1)下列物质:①CO2②盐酸③烧碱晶体④酒精⑤铁⑥纯醋酸(用编号回答)其中能导电的是,属于电解质的有;属非电解质的是。
(2)0.270kg质量分数为10%的CuCl2溶液中CuCl2 的物质的量,(带单位)
的物质的量,(带单位)
溶液中Cu2+和Cl-的物质的量分别为,。(带单位)
(3)标准状况下,224ml某气体的质量为0.32克,则该气体的相对分子质量。