(1)水中的重金属污染物主要包括 、 、 、 等,它们能在生物体内 ,不易排出体外,故危害很大。水中的重金属污染物可以通过水中的 ,浓度逐级加大,而人正处于 ,通过食物或饮水,将这些重金属摄入体内,引起人体急性或慢性中毒。
(2)写出水中的无机汞(如HgCl2)在微生物作用下转化为甲基氯化汞的化学方程式 。蛋白质水解的产物NH3在微生物作用下,进一步氧化为 ,进而氧化为 ,其过程用化学方程式表示为 , 。
铜是一种有色金属与人类关系非常密切。铜及其化合物在生产、生活中有广泛的应用。某同学对Cu的常见化合物的性质进行实验探究,研究的问题和过程如下:
(1)为探究不同价态铜的稳定性,进行如下实验:
向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子化学方程式为_________;由此可知,在酸性溶液中,+2价Cu比+1价Cu更(填“稳定”或“不稳定”)。
(2)硫酸铜是一种应用广泛的化工原料,实验室中可通过不同途径制取硫酸铜溶液和胆矾(CuSO4·5H2O),其中一种流程如图:
①杂铜(含少量有机物)灼烧后的产物除氧化铜还含少量铜,原因可能是________(填字母代号)。
a.该条件下铜无法被氧气氧化 b.灼烧不充分.铜未被完全氧化
c.氧化铜在加热过程中分解生成铜 d.灼烧过程中部分氧化铜被还原
②若将杂铜换为纯净的铜粉,可直接向其中加入稀硫酸和Fe2(SO4)3溶液,不断通入氧气。反应完全后向其中加入过量________(填化学式,下同),调节pH至,生成沉淀,过滤得硫酸铜溶液。已知:
| 氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
| Fe3+ |
2.7 |
3.7 |
| Fe2+ |
7.6 |
9.6 |
| Cu2+ |
4.7 |
6.7 |
(3)通过下述图1装置也可制取硫酸铜溶液(已知:2NaOH+2NO2=NaNO3+NaNO2+H2O)。
烧瓶内发生反应的化学方程式为__________________;
图2是图1的改进装置,
其优点有①____________________,②_________________ 。
(4)为测定CuSO4·5H2O晶体的纯度,进行下列实验:取a g试样配成l00 mL溶液,每次取20.00mL,消除干扰离子后,用b mol·L-1EDTA(Na2H2Y)标准溶液滴定其中的Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,平均消耗EDTA溶液l2.00 mL。(常温时,5%的Na2H2Y水溶液,其pH为4—6。)
①CuSO4·5H2O晶体的纯度是 。
②下列滴定方式中,最合理的是(夹持部分略去) (填序号)。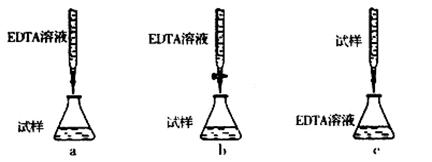
(10分)氨的合成是最重要的化工生产之一。
I.工业上合成氨用的H2有多种制取的方法:
① 用焦炭跟水反应:C(s)+ H2O(g)  CO(g)+ H2(g);
CO(g)+ H2(g);
② 用天然气跟水蒸气反应:CH4(g)+ H2O(g) CO (g)+ 3H2(g)
CO (g)+ 3H2(g)
已知有关反应的能量变化如下图,则方法②中反应的ΔH=_____________。
Ⅱ.在同温度下、使用相同催化剂分别进行反应:
3H2(g)+ N2(g) 2NH3(g),按不同方式在2L容器中投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
2NH3(g),按不同方式在2L容器中投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
3 mol H2、2 mol N2 |
6 mol H2、4mol N2 |
2 mol NH3 |
| 达到平衡的时间(min) |
t |
5 |
8 |
| 平衡时N2的浓度(mol·L-1) |
c1 |
1.5 |
|
| N2的体积分数 |
ω1 |
ω2 |
ω3 |
| 混合气体密度(g·L-1) |
ρ1 |
ρ2 |
(1)下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1︰3︰2b.v(N2)正=3v(H2)逆c.容器内压强保持不变d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t 5min (填>、<或=)
(3)乙中从反应开始到平衡时N2的平均反应速率(注明单位)。
(4)分析上表数据,下列关系正确的是________。
a.2c1=1.5mol/Lb.ω1=ω2 c.2ρ1=ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=______(用分数表示)。
(11分)有机物A、B的分子式均为C10H10O5,均能发生如下变化。根据题意回答下列问题:
已知:①A、B、C、D等均能与NaHCO3反应
②只有A、D能与FeCl3溶液发生显色反应,A苯环上的一溴代物只有两种
③F能使溴水褪色
④H不能发生银镜反应
⑤E是一种新型可生物降解的高分子材料
(1)转化过程中属于聚合反应的是、有机物D官能团的名称是、G物质的类型、⑥的反应类型:
(2)写出有机物的结构简式C、E、
(3)写出反应①的化学方程式
(4)D的同分异构体有很多种,写出同时满足下列要求的所有同分异构体的结构简式:
①能与FeCl3溶液发生显色反应;②能发生银镜反应且能水解;③苯环上的一卤代物只有2种。
W、X、Y和Z都是周期表中前20号元素,已知:
①W的阳离子与Y的阴离子具有相同的核外电子排布,且能形成组成为WY的化合物;
②Y和Z属同主族元素,它们能形成两种常见化合物;
③X和Z属同周期元素。它们能形成两种气态化合物;
④W和X能形成组成为WX2的化合物;
⑤X和Y不在同一周期,它们能形成组成为XY2的化合物。请回答:
(1)W元素的名称是;Z元素在周期表中的位置 。
(2)化合物XY2和WX2的电子式分别是和。
(3)X与Z,Y与Z可以形成同类化合物XZ2和YZ2;该类化合物按性质分类,叫。
(4)WX2与Z的氢化物反应可生成一种焊接、切割金属的原料气,反应的化学方程式:。
(1)下图是部分短周期元素原子半径与原子序数的关系图。
①由X、Y形成的既含离子键又含共价键的物质的电子式:
②实验室制备N单质的离子反应方程式:
(2)CaCO3是一种难溶物质,其Ksp=2.8×10-9。现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2.8×10-5mol/L,则生成沉淀所需CaCl2溶液的最小浓度为。
(3)羟胺(NH2OH) 可看成是氨分子内的l 个氢原子被羟基取代的产物,常用作还原剂,其水溶液显弱碱性。NH2OH 的水溶液呈弱碱性的原理与NH3的水溶液相似,用电离方程式表示NH2OH 在水溶液中显碱性的原因。
(4)“甲醇-空气”绿色燃料电池的工作原理示意图
写出以石墨为电极的电池工作时负极的电极反应式,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH=(溶液电解前后体积的变化忽略不计)。