学习了氢氧化钠的性质之后,知道氢氧化钠溶液中含有H2O、Na+、OH-,能使无色酚酞试液变红色,某科技小组想进一步探究是哪一种粒子使无色酚酞试液变红色。
【提出猜想】猜想①:可能是H2O ;猜想②:可能是Na+;猜想③:可能是OH-。
【实验验证】
| 实验操作 |
实验现象 |
结 论 |
| ①用试管取少量蒸馏水,滴入1滴~2滴无色酚酞试液,振荡 |
试管内溶液仍为无色 |
水分子不能使无色酚酞试液变红色 |
| ②用试管取少量氯化钠溶液,滴入1滴~2滴无色酚酞试液,振荡 |
|
|
| ③用试管取少量氢氧化钠溶液,滴入1滴~2滴无色酚酞试液,振荡 |
|
|
【讨论反思】有同学认为猜想①不需要实验验证就可以排除,你认为该同学的理由是 。
钢铁工业是国家工业的基础.
(1)如图1是教材中炼铁高炉及炉内化学变化过程示意图,根据图示回答下列问题.
若图中采用的铁矿石的主要成分为氧化铁,请写出A区和B区所发生主要反应的化学方程式:
A区.
B区.
(2)某兴趣小组在实验室中模拟炼铁化学原理的实验,对固体产物成分等进行探究.
【设计实验】
用一氧化碳还原纯净的氧化铁粉末,实验装置如图2.
【进行实验】
该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)
②反应后玻璃管和内盛黑色固体的总质量65.8g(冷却到室温称量)
【分析与讨论】
本实验中,玻璃管内固体粉末由红色全部变为黑色.小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家
提出查阅资料.
【查阅资料】
①一氧化碳还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关.
②一氧化碳还原氧化铁的实验过程中固体产物可能有四氧化三铁、氧化亚铁、铁.
③
| 物质 性质 |
四氧化三铁 |
氧化亚铁 |
氧化铁 |
铁粉 |
| 颜色 |
黑色 |
黑色 |
红色 |
黑色 |
| 能否被磁铁吸引 |
能 |
不能 |
不能 |
能 |
【实验与猜想】①该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和。
②进行猜想:黑色固体粉末可能a.全部为铁 b.c.
【得出结论】
通过实验中获得的数据进行计算,得出黑色固体粉末为(写名称)。
【反思与评价】
①一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度和延长反应时间.
②实验装置图中采用虚线框内的装置,其作用有。
A.收集一氧化碳 B.吸收二氧化碳 C.检验二氧化碳.
"江北水乡﹒运河古城"是今日枣庄的城市名片,而她又素以"煤城"著称。煤是一种重要的能源,工业上常把煤进行气化和液化处理,变为清洁能源。煤的气化和液化流程如下图所示:
【查阅资料】水煤气是混合气体,由两种无色无味的气体组成,可以燃烧。
【提出问题】水煤气是什么?
【猜想假设】根据资料和反应物判断,水煤气可能是:①一氧化碳和氢气;②二氧化碳和氢气。
(1)提出以上猜想的依据是。
【设计实验】请从下列装置中选择一种,设计简单的实验证明猜想。
(2)你选择的装置是(填字母代号),可能的现象为。
【实验结论】(3)那么,猜想(填序号)是合理的。
某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液滴加稀盐酸一会儿后,发现忘记了滴加指示剂.此时,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质的成分进行探究.
(1)写出该中和反应的化学方程式。
(2)探究烧杯内溶液中溶质的成分:
【提出问题】
该烧杯内的溶液中溶质是什么?
【进行猜想】
(A)溶质可能是
与
(B)溶质可能只是
(C)溶质可能是
与盐酸
【实验探究】
①小明从烧杯中取了少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液.振荡.观察到酚酞试液不变色.于是他排除了猜想(A),你认为他排除猜想(A)的理由是。
②小华想用碳酸钠溶液来验证后两种猜想,请你帮他完成实验,填写以下表格:
| 实验步骤 |
预计现象 |
预计结论 |
| 取少量反应后的溶液于试管中,逐滴加入碳酸钠溶液. |
猜想()正确 |
|
| 猜想()正确 |
【反思与拓展】
你认为上述烧杯内溶液如果未经处理直接倒入铁制下水道,可能造成的危害是.要想处理烧杯内溶液使其只得到
溶液,应向溶液中加入过量,充分反应后过滤,反应的方程式为。
某粗盐样品中含有杂质氯化镁、氯化钙.某同学设计了以下提纯方案: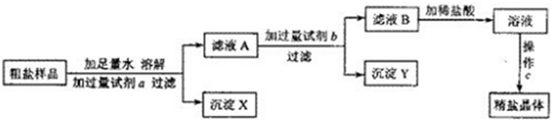
请回答下列问题:
(1)方案中加入过量试剂a若为氢氧化钠溶液,则其目的是为了除去粗盐中的。
(2)在过滤操作中,除用到带铁圈的铁架台、烧杯、玻璃棒外,还需要用到的仪器是。
(3)滤液B中所含的溶质为。
(4)向滤液B滴加稀盐酸的过程中,当观察到的溶液的现象为时,应停止滴加,如果滴加的稀盐酸过量,对最后得到的精盐晶体的成分(填"有"或"没有")影响。操作C的名称为。
工业上用电解饱和食盐水的方法可制取氢氧化钠、氢气、和氯气,写出反应的化学方程式。
实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样。已知它是无色液体,是初中化学常用的试剂。小强和小华很感兴趣,决定对其成分进行探究。
[提出问题]这瓶试剂可能是什么溶液呢?
[交流讨论]根据受损标签的情况判断,这瓶试剂不可能是__________。
A. 酸 B. 碱 C. 盐
[查阅资料]
Ⅰ. 初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。
Ⅱ. Na2CO3和NaHCO3溶液都呈碱性。
Ⅲ. 测定室温(20℃)时,4种物质的溶解度的数据如下表所示。
| 物质 |
NaCl |
NaOH |
Na2CO3 |
NaHCO3 |
| 溶解度g |
36 |
109 |
215 |
9.6 |
[得出结论]小华根据试剂瓶标注的溶质质量分数10%和上表中的溶解度的数据判断,这瓶试剂不可能是_________。
[作出猜想]①可能是________溶液;②可能是Na2CO3溶液;③可能是NaCl。
[设计并实验]
(1)小强用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH>7,这瓶试剂不可能是__________。
(2)小强为了检验该溶液是NaOH溶液还是Na2CO3溶液,他又进行了如下表所示实验:
[探究实验]
| 操作步骤 |
实验现象 |
结论及化学方程式 |
| 取样于试管中,滴加_____ |
产生大量的气泡 |
猜想②正确 |
把产生的气体通入 |
相关的化学方程式是: |
[拓展与应用]请你选择与小强不同的试剂,来鉴别NaOH溶液和Na2CO3溶液,你选择__________溶液。