一次性塑料包装袋造成的环境污染已经引起社会的高度关注,许多城市已经开始推广使用纸制食品袋。同学们经查阅资料得知,纸袋的组成成分中一定含有碳元素和氢元素,可能含有氧元素,于是他们利用以下装置进行实验测定。请回答下列问题:
(1)实验中C装置内发生反应的化学方程式为 。
(2)实验中选择纯净的氧气而不用空气的原因是 。
(3)为分别吸收纸袋充分燃烧的产物,并通过清晰可见的现象检验吸收是否安全高效,以上实验装置正确的连接顺序是A→( )→( )→( )→( )(填写装置的字母代号)
(4)将实验装置正确连接之后,确认气密性良好,充分燃烧16.2 g纸袋样品,测得相关实验数据见表(假定燃烧产物被完全吸收,灰烬质量忽略不计)
| 装置 |
实验前装置的质量 |
实验后装置的质量 |
| B |
200.0 g |
200.0 g |
| C |
210.0 g |
234.2 g |
| D |
220.0 g |
229.0 g |
| E |
210.0 g |
212.2 g |
通过分析和计算可推断得出,纸袋样品中 (填“含”或“不含”)氧元素,其碳、氢两种元素的原子个数的最简整数比为 。
人类的生存离不开氧气.某校化学兴趣小组的同学在老师的指导下做了有关氧气的系列探究实验:
探究一:以下是该小组探究影响H2O2溶液反应速率部分因素的相关实验数据.
| 实验序号 |
H2O2溶液 浓度% |
H2O2溶液 体积/mL |
温度/℃ |
MnO2的 用量/g |
收集氧气的 体积/mL |
反应所需 的时间/s |
| ① |
5 |
1 |
20 |
0.1 |
4 |
16.75 |
| ② |
15 |
1 |
20 |
0.1 |
4 |
6.04 |
| ③ |
30 |
5 |
35 |
0 |
2 |
49.21 |
| ④ |
30 |
5 |
55 |
0 |
2 |
10.76 |
⑴ 写出实验室用H2O2溶液和MnO2混合制氧气的文字或符号表达式:。
⑵ 通过实验①和②对比可知,化学反应速率与有关;
从实验③和④对比可知,化学反应速率与温度的关系是:。
⑶ 通过上述实验(填“能”或“不能”)说明使用MnO2可以加快H2O2溶液反应速率.
探究二:某化学兴趣小组的同学对空气中氧气含量的测定实验进行探究.
已知:在空气中,温度超过40℃,白磷(化学符号为P)就可以自燃,即和氧气反应生成五氧化二磷。
如图是“空气中氧气体积分数测定”实验的改进装置.主要操作是:在实际容积为150mL的集气瓶里,先装进50mL的水,再按图连好仪器,按下热的玻璃棒,白磷立即被点燃.
⑴请写出白磷与氧气反应的文字或符号表达式
⑵ 白磷从燃烧到熄灭冷却的过程中,瓶内水面的变化是;若实验非常成功,最终集气瓶中水的体积约为mL.
⑶ 集气瓶里预先装进的50mL水,在实验过程中起到哪些作用?(填写序号)
a.加快集气瓶冷却
b.液封导气管末端以防气体逸出
c.缓冲集气瓶内气压的骤然升高.
某同学设计了测定空气中氧气含量的实验,实验装置如图。
该同学的实验步骤如下。请回答实验中有关问题:
①将图中的集气瓶分为5等份,并作好标记。
②在带橡皮塞和导管的燃烧匙内装入足量的红磷,
将导管上的止水夹夹紧,在酒精灯上点燃红磷,并立即
伸入集气瓶内,塞紧橡皮塞。
③充分反应后,待集气瓶冷却至室温,打开止水夹。
(1)该实验中红磷需稍过量,目的是。
(2)步骤②集气瓶中发生反应的文字表达式为;步骤③中打开止水夹后观察到的现象是,由此可得出空气中氧气的体积分数约为。
(3)该实验可推论出氮气(填“易”或“难”)溶于水和其化学性质(填“活泼”或“不活泼”)的结论。
(4)该实验中的红磷不能用碳代替,原因是
为测定空气中氧气的含量,小华同学打算设计如下方案:选实际容积为40毫升的试管做反应容器。将过量白磷放入试管中,用橡皮塞塞紧试管口,通过导管与实际容积为60毫升,且润滑性很好的针筒注射剂组成如左图。假设此实验能按小华的设想正常进行且白磷和导管内空气所占体积忽略不计,请回答下列问题:
①验钱前,打开弹簧夹,将注射剂的活塞前远沿从20毫升推至15毫升刻度处,然后松手,若活塞仍能返回至20毫升刻度处,则说明
②若现夹紧弹簧夹,用酒精灯加热白磷,燃烧结束,等到试管冷却后,再松开弹簧夹,可观察到注射器活塞停留在ml处
③若不使用弹簧夹,用酒精灯加热白磷,充分反应后,试管冷却,可观察到注射器活塞停留在ml处
④若按小华的设想进行实验,实际遇到诸多问题而发生危险,造成实验失败。如
某校化学兴趣小组就空气中氧气的含量进行实验探究: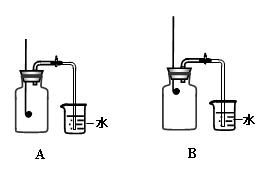
[集体讨论]
(1)讨论后同学们认为,选择的药品既要能消耗氧气,又不会跟空气中的其它成分反应,而且生成物为固体。他们应该选择(填编号),
A.蜡烛 B.红磷 C.硫粉
为了充分消耗容器中的氧气,药品的用量应保证。
(2)小组同学共同设计了如上图的两套装置,你认为合理的是(填编号)。
为了确保实验的成功,在装药品之前应该。
[分组实验]在讨论的基础上,他们分组进行了实验。
[数据分析]实验结束后,整理数据如下:(注:集气瓶容积为100mL)
| 组别 |
1 |
2 |
3 |
4 |
5 |
6 |
| 进入集气瓶中水的体积(mL) |
20 |
21 |
19 |
20 |
22 |
18 |
(3)通过对实验结果的交流,大多数同学都验证出氧气约占空气体积的。
通过实验还可以推断集气瓶中剩余气体是。
[实验拓展]
(4)小组的同学做完实验后又尝试用木炭重新做了以上实验,发现水几乎没有进入集气瓶。经讨论,同学们一致认为如果事先在集气瓶内注入少量碱溶液来吸收木炭燃烧产生的气体,实验也能取得较好的效果。
以下是某研究小组探究影响化学反应快慢的一些因素的相关数据(常温通常指20℃;“浓度”指溶质的质量分数)
| 实验序号 |
过氧化氢溶液浓度/% |
过氧化氢溶液质量/g |
温度/℃ |
二氧化锰用量/g |
氧气体积/ml |
反应所需时间/s |
| ① |
5 |
12 |
20 |
0.2 |
125 |
11 |
| ② |
30 |
12 |
20 |
0.2 |
125 |
2 |
| ③ |
30 |
12 |
40 |
/ |
125 |
148 |
| ④ |
30 |
12 |
90 |
/ |
125 |
82 |
(1)通过实验①和②对比可知,化学反应快慢与有关,其关系是。
(2)通过对比实验和可知,化学反应快慢与温度的关系是。
(3)除了上述的两个因素能影响化学反应快慢,你认为另一个影响因素是什么,其关系是怎样的?。
(4)由上述实验可知,实验室用过氧化氢制取氧气的最合适的条件是
。