取少量Fe2O3粉末(红棕色)加入适量盐酸,发生反应的化学方程式: ,反应后得到的溶液呈 色。用此溶液分别做如下实验:
(1)取少量溶液置于试管中,滴入几滴NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为 ,此反应属于 。
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈 色,即制得Fe(OH)3胶体。
(3)取另一只小烧杯也加入20 mL蒸馏水,向烧杯中加入1 mL FeCl3溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到 烧杯中的液体产生丁达尔效应。这个实验可以用来区别 。
(4)取乙烧杯中少量Fe(OH)3胶体置于试管中,向试管中滴加一定量的稀HI溶液,边滴加边振荡,会出现一系列变化。
①先出现红褐色沉淀,随后沉淀溶解,溶液呈黄色,写出此反应的离子方程式: 。
②最后溶液颜色加深,原因是 。(用离子方程式表示)。
③用稀盐酸代替稀HI溶液,能出现上述哪些相同的变化现象 (写序号)。
已知:①x是短周期元素组成的单质,Z是一种常见化合物。②A、B、C、D、E、F都是常见的化合物,常温下C是气体,D是液体。A溶液的焰色反应为黄色。自然界中存在较多的E矿石,工业生产中常用这种矿石来制取F。③存在下列转化关系:
试回答:
(1)Y的电子式:,X元素在周期表中的位置
C分子中的化学键类型
(2)Y转化为Z的化学方程式:
A转化为E的离子方程式(Z过量):
(6分)目前,化学家们已合成了一系列有机物:
联苯联三苯联四苯联m苯
根据这一系列有机物的规律,试回答:
(1)写出联m苯的化学式(用m表示)
(2)该系列有机物中,其中含碳量最高的化合物碳含量百分率约为
(保留三位有效数字)
(3)若联苯中C—C能自由旋转,那么联苯的二氯取代物有种
(18分)A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,A与D、C与F分别为同一主族,A、D两元素的原子核内的质子数之和是C、F两元素原子核内质子数之和的一半。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为,其Y分子属于(填“极性”、“非极性”)分子。
(2)E是非金属元素,但能表现出一些金属元素的性质,请写出单质E与氢氧化钠溶液反应的离子方
程式
(3)一定条件下,A的单质气体与B的单质气体充分反应生成6.8g W气体[已知n(A):n(B)=3:1],可放出18.44 kJ热量,则该反应的热化学方程式
(4)A的单质与C的单质在KOH的浓溶液中可以形成原电池,如果以金属M和金属N为惰性电极,在电池的M极通入A的单质气体,N极通入C的单质气体,则N极的电极反应式。
(5)在10升的密闭容器中,通入2mol的FC2气体和3molC的气体单质,一定条件下反应后生成FC3气体,当反应达到平衡时,单质C的浓度为0.21mol/L,则平衡时FC2的转化率为。
(10分)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是。
(2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为。
(3)根据上述反应可推知。
a.氧化性:KBrO3 >H3 AsO4 b.氧化性:H3AsO4 >KBrO3
AsO4 b.氧化性:H3AsO4 >KBrO3
c.还原性:AsH3>X d.还原性:X >AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目: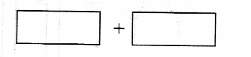
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸汽能发生氧化还原反应,其反应产物有:HF、NO、HNO3,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素的物质的量之比为。
(2)写出该反应的化学方程式。
若反应中生成0.2 mol HNO3,转移的电子数目为个。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是。
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF 、H2O外,还肯定有(填化学式)。