海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示)。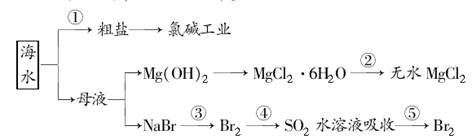
下列有关说法不正确的是( )
| A.从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能的过程 |
| B.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2 |
| C.在过程③⑤中溴元素均被氧化 |
| D.过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入化学药品的顺序为:Na2CO3溶液―→NaOH溶液―→BaCl2溶液―→过滤后加盐酸 |
由金红石(TiO2)制取单质Ti涉及到的步骤为:
TiO2 TiCl4
TiCl4 Ti
Ti
已知:①C(s)+O2(g)=CO2(g)DH=-393.5kJ·mol-1
②2CO(g)+O2(g)=2CO2(g)DH=-566kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g)DH=+141kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH是
| A.-80kJ·mol-1 | B.-160kJ·mol-1 | C.160kJ·mol-1 | D.80kJ·mol-1 |
工业上用Na2CO3溶液浸泡锅炉水垢使其中CaSO4能转化为CaCO3,下列有关CaSO4和CaCO3性质有关推测正确的是
| A.CaSO4是一种强酸弱碱盐 |
| B.CaSO4溶解度小于CaCO3 |
| C.CaSO4溶解度大于CaCO3 |
| D.CaSO4溶解度等于CaCO3 |
200mL0.1 mol·L-1CH3COOH与200mL0.1 mol·L-1NaOH溶液混合后,离子浓度关系正确的是
| A.c(Na+)=c(CH3COO-)+c(CH3COOH) |
| B.c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| C.c(Na+)+c(OH-)= c(CH3COO-)+c(H+) |
| D.c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
短周期金属元素甲~戊在元素周期表中的相对位置如表中所示。下列判断正确的是
| 甲 |
乙 |
|
| 丙 |
丁 |
戊 |
A.金属性:甲>丙
B.原子半径:丙<丁<戊
C.最外层电子数:甲>乙
D.氢氧化物的碱性:丙>丁>戊
将下表中的Y物质加入或通入X物质中反应,所得溶液中一定只含一种溶质的是
| 选项 |
X物质 |
Y物质 |
| A |
NaOH溶液 |
CO2 |
| B |
蒸馏水 |
金属Na |
| C |
Ca(OH)2溶液 |
Cl2 |
| D |
Al2(SO4)3溶液 |
Ba(OH)2溶液 |