在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
Ⅰ.向废液中投入过量铁屑,充分反应后分离出固体和滤液;
Ⅱ.向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
已知:Ksp[Fe(OH)3]=4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为______________________________;
(2)过程Ⅰ加入铁屑的主要作用是________,分离得到固体的主要成分是______________,从固体中分离出铜需采用的方法是________________;
(3)过程Ⅱ中发生反应的化学方程式为______________;
(4)过程Ⅱ中调节溶液的pH为5,金属离子浓度为________。(列式计算)
(1)标准状况下,2.24LCH4、HCHO、C2H6的混合气充分燃烧后,生成CO2 0.14mol,该混合气体中C2H6的体积分数
(2)某气态不饱和烃在标准状况下的密度为2.41g/ L。取0.54 g该烃恰好与浓度为0.2 mol / L的溴水100mL完全反应,使溴水完全褪色。求该烃的分子式及结构简式
有机物间存在如下转化关系: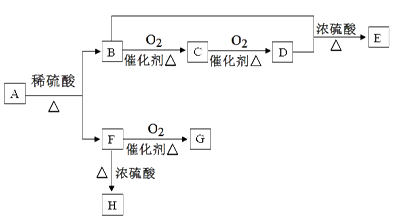
已知:①G、E均能发生银镜反应;②H的结构简式为
回答下列问题:
(1)写出A的分子式
(2)写出E的结构简式
(3)F分子中含有的官能团的名称是
(4)由A转化成B和F的反应类型属于 (填序号)
①氧化反应 ②消去反应 ③取代反应 ④还原反应
(5)写出由B生成C的化学方程式为(有机物用结构简式表示)
(6)F的同分异构体中,能使三氯化铁溶液显色,苯环上只有两个取代基,且1 molF与钠反应产生0.5molH2的同分异构体有 种
工业制硝酸的主要反应是:4NH3(g)+5O2(g) 4NO(g)+6H2O (g) ΔH=" -1025" KJ/mol
4NO(g)+6H2O (g) ΔH=" -1025" KJ/mol
(1)一定温度下,现将0.8mol NH3和1.5mol O2充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是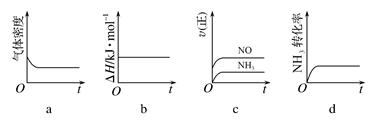
(2)在容积为1L的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 |
c(NH3)(mol/L) |
C(O2)(mol/L) |
C(NO)(mol/L) |
| 起始 |
0.8 |
1.5 |
0 |
| 第2min |
0.7 |
a |
0.1 |
| 第4min |
0.4 |
1.0 |
0.4 |
| 第6min |
0.4 |
1.0 |
0.4 |
| 第8min |
1.2 |
2.5 |
0.4 |
①起始时物料比c (O2) : c (NH3)>1.25,其原因是
②反应在第2min到第4min时O2的平均反应速率为mol·L-1·min-1
③反应在第2min改变了反应条件,改变的条件可能是(填字母序号)
a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度
④反应在第8min改变的反应条件可能是,再次达到平衡时,NO的体积分数(填“增大”、“减小”或“不变”)
(3)室温下,将第一次达到平衡时的混合气体通入水中,然后向该溶液滴加b L氨水后溶液呈中性,则滴加氨水的过程中,溶液中水的电离平衡将(填“正向”“ 逆向”或“不”)移动,所滴加氨水的浓度为mol·L-1。(NH3·H2O的电离平衡常数Kb=2×10-5 mol·L-1)
某兴趣小组为研究乙酸乙酯的制取,进行如下实验。
实验一用乙醇和乙酸制取乙酸乙酯
甲、乙同学分别使用图1、图2装置制取乙酸乙酯。
图1图2
(1)制取乙酸乙酯的化学方程式为
(2)将饱和碳酸钠溶液换成氢氧化钠溶液是否可行,并解释原因
(3)图1导管末端不能插入饱和碳酸钠溶液,而图2装置中的仪器C的末端可以插入饱和碳酸钠溶液的原因是
实验二测定乙酸乙酯的纯度
取乙同学所得乙酸乙酯样品1.0 g,放入20.00 mL 0.500 mol.L-1的NaOH溶液中,充分振荡四小时,滴入两滴酚酞后,用0.075 mol·L-1的盐酸标准溶液滴定,重复三次实验测得盐酸用量的平均值为20.00 mL。
(4)该乙酸乙酯样品的纯度为
(5)达到滴定终点时,溶液颜色由变为
(6)下列操作能引起乙酸乙酯纯度偏低的原因是
| A.酸式滴定管未润洗 | B.酸式滴定管滴定前有气泡,滴定后气泡消失 |
| C.配制盐酸标准液时,定容俯视 | D.乙酸乙酯未完全水解 |
E.乙酸乙酯中含有乙酸 F.锥形瓶未润洗
下图物质A~K均由a、b、c、d、e、f五种元素组成。a、b、c、d、e、f为原子序数依次增大的短周期元素;由a、b、c、d四种元素形成酸式盐A;b的最外层电子数是电子层数的2倍;由d、e元素可形成两种离子化合物,且阳离子与阴离子的个数比都为2 : 1,其中一种为X;B、C、D为常见的气体;F为白色胶状物质。(部分产物未列出)
(1)物质A的化学式_______________
(2)Y的溶液呈性(填“酸性” 、“碱性” 或“中性”),用离子反应方程式解释原因:
(3)将溶液K蒸干灼烧,得到的固体产物为,此固体产物的用途是(答出一条即可)
(4)B与H在一定条件下反应生成c单质和G,反应中氧化产物与还原产物物质的量之比为
(5)常温下,向0.1mol/L的K溶液中加入Na2O2,加入Na2O2的质量与产生沉淀的质量具有如图所示关系
①当溶液pH=,开始生成沉淀(已知生成沉淀的Ksp=1×10-31 )
②p点时产生沉淀与放出气体的物质的量之比为
③从开始加Na2O2固体至q点的整个过程中,总反应的离子方程式为。