有一白色固体混合物,可能含有有的阴、阳离子分别是
| 阳离子 |
K+ Ba2+ Ag+ Mg2+ NH4+ Na+ |
| 阴离子 |
SO42- SO32- CO32- AlO2- |
为了鉴定其中的离子,现进行如下实验,根据实验现象,填写下列表格:
(1)取该粉末,加水后得到无色溶液,且未嗅到气味;用pH试纸测得溶液的pH为12。
| 排除的离子 |
排除的依据 |
(2)向溶液中滴加盐酸溶液,开始有沉淀生成,继续滴加,沉淀消失,同时有无色无味气体逸出。
| 肯定存在的离子 |
判断依据 |
| 排除的离子 |
排除的依据 |
(3)尚待检验的离子及其检验方法
| 尚待检验的离子 |
检验方法 |
有浓度为0.1的盐酸、硫酸、醋酸在种溶液,试回答:
(1)三种溶液中c(H+)依次为a mol•L-1、mol•L-1b mol•L-1、c mol•L-1,大小顺序为________;
(2)等体积的以上三种酸分别与过量的NaOH 溶液反应,生成的盐的物质的量依次为n 1mol,n2 mol,n3 mol,它们的大小关系为________;
(3)中和等量NaOH溶液都生成正盐时,分别需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为________;
(4)与等量锌反应时产生氢(气)的速率分别为v1、v2、v3,其大小关系为________。
在稀氨水中存在平衡:NH3+H2O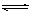 NH4++OH-,进行如下操作,则NH3、NH4+、H+、OH-浓度如何变化?请用“增大”“减小”“不变”填写。
NH4++OH-,进行如下操作,则NH3、NH4+、H+、OH-浓度如何变化?请用“增大”“减小”“不变”填写。
(1)通适量HCl气体时,c(NH3)_________,c(H+)_________;
(2)加入少量NaOH固体时,c(NH4+)_________,c(H+)_________;
(3)加入NH4Cl晶体时,c(NH4+)_________,c(H+)_________。
中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
Ⅰ.将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度 /mol.L-1 |
4×10-5 |
6×10-5 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断PM2.5的酸碱性,试样的pH=_________。
Ⅱ.NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
①N2(g)+O2(g) 2NO(g)△H=________。
2NO(g)△H=________。
②当尾气中空气不足时,NOx在催化转化器中被还原成N2排出.写出NO被CO还原的化学方程式___。
2CO(g)═2C(s)+O2(g),已知该反应的△H>0,该设想不能实现,他的依据是_______。
Ⅲ.碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
①用离子方程式表示反应器中发生的反应___________________________。
②用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池.电池充放电时的总反应为:Ni(OH)2+M  NiO(OH)+MH,电池放电时,负极电极反应式为:________________________。
NiO(OH)+MH,电池放电时,负极电极反应式为:________________________。
结构决定性质,性质体现结构。对结构和性质的研究是学好化学的基础。
Cu2Cl2·2CO·2H2O是一种配合物,其结构如图所示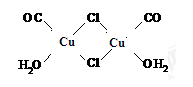
工业上制备该物质的反应如下:2CuCl+2CO+2H2O=Cu2Cl2·2CO·2H2O
(1)该配合物中金属阳离子的核外电子排布式为______________________;
(2)与CO为互为等电子体的阴离子是_______________(写一种即可)。
第二周期元素中,第一电离能介于B、N之间的元素除C外,还有_______(填元素符号)。
(3)该配合物中,氯离子的杂化方式为__________;用“ ”标出该物质中配位键。
”标出该物质中配位键。
(4)CuCl的晶胞如右图所示,距离每个Cu+最近的Cl-的个数为_______。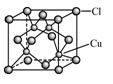
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等。
(1)已知:
N2(g)+2H2(g)=N2H4(l)△H=+50.6kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1
则①N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=______________kJ•mol-1
②用次氯酸钠氧化氨气,可以得到N2H4的稀溶液,该反应的化学方程式是___________________。
(2)污水中的NH4+可以用氧化镁处理,发生如下反应:
MgO+H2O Mg(OH)2 Mg(OH)2+2NH4+
Mg(OH)2 Mg(OH)2+2NH4+ Mg2++2NH3•H2O
Mg2++2NH3•H2O
①温度对氮处理率的影响如图所示.在25℃前,升高温度氮去除率增大的原因是___________________。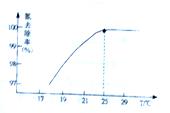
②剩余的氧化镁,不会对废水形成二次污染,理由是___________________。
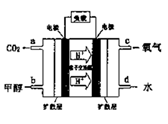
(3)污水中的含氮化合物,通常先用生物脱氮工艺进行处理,在硝化细菌的作用下将NH4+氧化为NO3-(2NH4++3O2=2HNO2+2H++H2O;2HNO2+O2=2HNO3),然后加入甲醇,NO3-和甲醇转化为两种无毒气体。
①上述方法中,14g铵态氮元素转化为硝态氮元素时需氧的质量为_____________g。
②请写出加入甲醇后反应的离子方程式___________________。
(4)甲醇燃料电池的工作原理如下图所示,则该电池负极的电极反应式为_________。