已知反应AsO43—+2I-+2H+ AsO32—+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作:
AsO32—+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作:
Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40% NaOH溶液
结果发现电流计指针均发生偏转。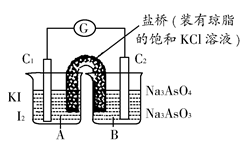
据此,下列判断正确的是 ( )
| A.操作Ⅰ过程中,C1为正极 |
| B.操作Ⅱ过程中,盐桥中的K+移向B烧杯溶液 |
| C.操作Ⅰ过程中,C2棒上发生的反应为:AsO43—+2H++2e-=AsO33—+H2O |
| D.操作Ⅱ过程中,C1棒上发生的反应为:2I-=I2+2e- |
根据反应式:①2Fe3++2I-=2Fe2++I2②Br2+2Fe2+=2Fe3++2Br-可判断离子的还原性从强到弱的顺序是()
| A.Br-.Fe2+.Cl- | B.I-.Fe2+.Br- |
| C.Br-.I-.Fe2+ | D.Fe2+.I-.Br- |
下列性质中,可以证明某化合物中一定存在离子键的是()
| A.可溶于水 | B.具有较高的熔点 |
| C.水溶液一定能够导电 | D.熔融状态能够导电 |
航天技术上使用一种氢氧燃料电池,它具有高能轻便、不污染环境等优点,该电池总反应方程式为:2H2+O2=2H2O,该电池的正极反应可表示为
| A.O2+4H++4e-=2H2O | B.2H2-4e-=4H+ |
| C.4OH--4e-=O2↑+2H2O | D.O2+2H2O+4e-=4OH- |
已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量
下列叙述正确的是
| A.氢气和氯气反应生成氯化氢气体的热化学方程式是 H2(g)+Cl2(g) = 2HCl(g) |
| B.氢气和氯气反应生成2 mol氯化氢气体,反应的DH =" 183" kJ/mol |
| C.氢气和氯气反应生成2 mol氯化氢气体,反应的DH =-183 kJ/mol |
| D.氢气和氯气反应生成1 mol氯化氢气体,反应的DH =-183 kJ/mol |
有一电解池中X,Y分别是直流电源的两极,通电后发现a极(连X)板质量增加,b极(连Y)板处有无色无臭气体放出,符合这一情况的是附表中的
附表可供选择的极板、电极和溶液组
| 组合 |
a极板 |
b极板 |
X电极 |
Z溶液 |
| A |
锌 |
石墨 |
负极 |
CuSO4 |
| B |
石墨 |
石墨 |
负极 |
NaOH |
| C |
银 |
铁 |
正极 |
AgNO3 |
| D |
铜 |
石墨 |
负极 |
CuCl2 |