铝的阳极氧化是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。
某化学研究小组在实验室中按下列步骤模拟铝表面“钝化”的产生过程。
(1)配制实验用的溶液。要配制200 mL密度为1.2 g/cm3的溶质质量分数为16%的NaOH溶液,需要称取________g NaOH固体。
(2)把铝片浸入热的16%的NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗,写出除去氧化膜的离子方程式:________。
(3)按下图组装好仪器,接通开关K,通电约25 min。在阳极生成氧化铝,阴极产生气体。
写出该过程中的电极反应式:
阳极:_________________________________________;
阴极:_________________________________________。
(4)断开电路,取出铝片,用质量分数为1%的稀氨水中和表面的酸液,再用水冲洗干净。写出该过程发生反应的离子方程式:______________________。
Al2O3、Al(OH)3都是重要化工原料。根据要求回答问题:
Ⅰ、电解法制高品质Al(OH)3装置如下(中间用离子交换膜隔开):
4Na[Al(OH)4]+2H2O 4Al(OH)3↓+4NaOH+O2↑+2H2↑
4Al(OH)3↓+4NaOH+O2↑+2H2↑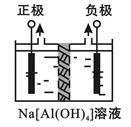
(1)产物Al(OH)3在区(填“阴极”或“阳极”)沉积;
(2)电解中转移2mol e—时,将制得__________mol的Al(OH)3。
Ⅱ、制取纳米Al2O3需要纯净的硫酸铝。现有0.05mol·L-1硫酸铝溶液,经检测,含有Fe2+、Fe3+。可按下述操作提纯:往溶液中加足量H2O2充分反应,再用试剂X调节溶液pH=3.5。(室温下,0.1mol·L-1的Fe2+、Al3+开始沉淀的pH分别为7.0和3.7,Fe3+完全沉淀的pH=3.2)
(3)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为_________m。
(4)检验硫酸铝溶液含有Fe3+时,所采用的试剂及现象是_____________________。
(5)往溶液中加入H2O2的作用是(用离子方程式表示)。
(6)加入的X试剂(填选项编号)是。
| A.CuO | B.Al(OH)3 | C.NaOH | D.NaHCO3 |
若调节后溶液的pH偏离3.5,可能带来的后果是__________________________。
甲、乙、丙是常见的三种物质,它们之间有如图所示的转化关系。根据要求回答问题: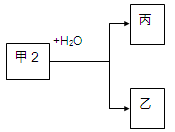
I、已知:甲是常见单质,丙为氢气。
(1)若乙为氧化物且有磁性,则乙发生铝热反应的化学方程式为。
(2)若甲为碳,则产物乙、丙可合成甲醇。
①已知:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
CH4(g)+H2O(g) CH3OH(g)+H2(g) ΔH=+77.0 kJ·mol-1
CH3OH(g)+H2(g) ΔH=+77.0 kJ·mol-1
写出气体乙与气体丙反应生成CH3OH(g)的热化学方程式:__________________。
②乙和丙合成甲醇的反应在不同温度下的化学平衡常数(K)如下表。则T1 ______ T2(填“>”、“<”、“=”)。
| 温度/℃ |
T1 |
T2 |
| K |
2.041 |
0.012 |
③乙可做某碱性燃料电池的燃料,该电池的负极反应式为_________________。
II、已知:甲是由两种短周期元素组成的化合物,丙的水溶液显碱性。
(3)若构成甲的阴、阳离子个数比为2:3,丙是气体。则构成甲的阴、阳离子半径大小关系为(用具体的微粒表示)。
(4)若乙是O2,则甲的一种重要用途是;产物丙与Cl2按2:1(物质的量)反应得到丁溶液,丁溶液中阴离子浓度从大到小的顺序是。
(1)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义。为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-。电池工作时正极反应式为。
若以该电池为电源,用石墨做电极电解100 mL含有如下离子的溶液。
| 离子 |
Cu2+ |
H+ |
Cl- |
 |
| c/mol·L-1 |
1 |
4 |
4 |
1 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气标况下的体积为L。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程:
①写出阳极电极反应式;
②除去甲醇的离子反应为,该过程中被氧化的元素是,当产生标准状况下2.24 L CO2时,共转移电子mol。
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: I1=738 kJ·mol-1 I2=1451 kJ·mol-1 I3=7733 kJ·mol-1 I4=10540 kJ·mol-1 |
| D原子价电子层的p轨道半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(1)写出BA3的电子式:________。
(2)B元素基态原子中能量最高的电子,其电子云在空间有________个取向,原子轨道呈________形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为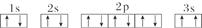
该同学所画的电子排布图违背了______________________________________。
(4)比较B和D的电负性_________>_______(填元素符号)
(5)G位于________族________区,该元素的核外电子排布式为________________________。
(6)检验F元素的方法是____________,请用原子结构的知识解释产生此现象的原因:_____。
工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用。
(1)某制革厂含硫废水中主要含有物是Na2S。
①常温下,测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因。
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为。已知1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g) 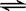 Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法: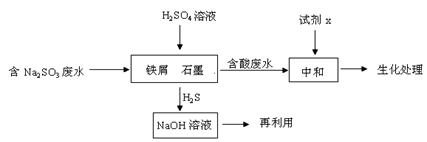
①H2S气体与足量NaOH溶液反应的化学方程式
②铁屑与石墨能形成微型原电池,SO32—在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32—在酸性条件下放电生成H2S的电极反应式:。