在一密闭恒容的容器中,可逆反应3A(g) 3B(?)+C(?)的能量变化如图甲所示,气体的平均相对分子质量随时间的变化如图乙所示。
3B(?)+C(?)的能量变化如图甲所示,气体的平均相对分子质量随时间的变化如图乙所示。
(1)由图甲可以判断3A(g) 3B(?)+C(?)的正反应是________反应(填“吸热”或“放热”),实验a和实验b相比较,可能隐含的反应条件是________。
3B(?)+C(?)的正反应是________反应(填“吸热”或“放热”),实验a和实验b相比较,可能隐含的反应条件是________。
(2)由图乙可以得出有关B和C状态的结论是________。
①若t2时刻升高温度,气体的平均相对分子质量变化一定符合________线(填“c”“d”或“e”)。
②若改变压强,气体的平均相对分子质量变化一定符合c线,则C物质的状态为________。
(3)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则B是________状态,C是________状态。
(4)如果B为气体,C为固体,取0.3 mol A恒温下在1 L容器中充分反应,平衡时测得B的浓度为0.21 mol/L。若使反应从逆反应开始,起始时在容器中加入0.3 mol B,同样条件下,要使平衡时B的浓度仍为0.21 mol/L,则C的物质的量的取值范围应该是________。
ZnMnO2干电池应用广泛,其电解质溶液是ZnCl2NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是____________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
| A.NaOH | B.Zn | C.Fe | D.NH3·H2O |
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是___________。若电解电路中通过2 mol电子,MnO2的理论产量为________g。
化学电池是将化学能转变成电能的装置,包括一次电池、二次电池和燃料电池等几大类。燃料电池是目前正在探索的一种新型电池,已经使用的氢氧燃料电池的基本反应是:
X极:O2+2H2O+4e-=4OH-
Y极:2H2+4OH—=4H2O+4e-
请回答下列问题 :
(1)X是 极;Y极发生 反应(填“氧化”或“还原”)
(2)该电池总反应方程式为 。
(3)若反应后的得到5.4 g液态水,此时氢氧燃料电池转移的电子数为 。
(4)实验室用铅蓄电池作电源电解饱和食盐水,若制得Cl2 0.30 mol,电池内至少消耗H2SO4 mol。
现有浓度均为0.1 mol/L的下列溶液:①硫酸.②醋酸.③氢氧化钠.④氯化铵.⑤醋酸铵.⑥硫酸铵.⑦硫酸氢铵.⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+的浓度由大到小的顺序是(填序号)________________.
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)________________.
(3)将③和④等体积混合后,溶液中各离子浓度由大到小的顺序是______ .
(4)已知t℃时,KW=1×10-13,则t℃(填“>”.“<”或“=”)______25℃.在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b________.
现有NH4Cl和氨水组成的混合溶液。请回答下列问题(填“>”、“<”或“=”):
(1)若溶液的pH=7,则该溶液中c(NH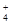 )_________c(Cl—)。
)_________c(Cl—)。
(2)若溶液的pH>7,则该溶液中c(NH+)_________c(Cl—)。
(3)若c(NH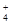 )<c (Cl—),则溶液的pH__________7。
)<c (Cl—),则溶液的pH__________7。
在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如下图所示,请回答: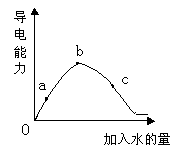
(1)“O”点导电能力为0的理由是: 。
(2)a、b、c三点溶液中,[H+]由小到大的顺序是: 。
(3)a、b、c三点溶液中,醋酸的电离程度最大的是: 。
(4)若使c点溶液中[CH3COO-]增大,而[H+]减小,可采取的措施主要有:① ;② ;③ ;④ 。