某无色透明溶液中可能大量存在OH-、Cl-、Na+、Mg2+、Cu2+中的几种离子。
(1)不做任何实验就可以肯定原溶液中不存在的离子是_______。
(2)取少量原溶液加入铝粉有气体放出,说明原溶液中肯定存在的离子是___________,有关的离子方程式为:____________________________。
(3)另取少量原溶液加入过量稀硝酸,再加几滴AgNO3溶液,出现白色沉淀,说明原溶液中肯定存在的离子有_________。
(4)原溶液中_________(填“肯定存在” 、“肯定不存在”或 “无法确定”) Na+。
硼元素B在化学中有很重要的地位。硼的化合物在农业、医药、玻璃等方面用途很广。请回答下列问题:
(1)写出与B元素同主族的Ga元素的基态原子核外电子排布式_________________。
从原子结构的角度分析,B、N、O元素的第一电离能由大到小的顺序为___________。
(2)立方氮化硼可利用人工方法在高温高压条件下合成,属于超硬材料。同属原子晶体的氮化硼(BN)比晶体硅具有更高硬度和耐热性的原因是_____________________________。
(3)在BF3分子中中心原子的杂化轨道类型是__________,SiF4微粒的空间构型是__________。又知若有d轨道参与杂化,能大大提高中心原子成键能力。试解释为什么BF3、SiF4水解的产物中,除了相应的酸外,前者生成BF4一后者却是生成SiF62—:_______________________________________。
(4)科学家发现硼化镁在39K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。
上图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据图示确定硼化镁的化学式为_______。
利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
(一)染料工业排放的废水中含有大量有毒的NO,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO的离子方程式为________。
(二)某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 |
Fe3+ |
Fe2+ |
Mg2+ |
Al3+ |
Cu2+ |
Cr3+ |
| 开始沉淀 时的pH |
1.9 |
7.0 |
— |
— |
4.7 |
— |
| 沉淀完全 时的pH |
3.2 |
9.0 |
11.1 |
8 |
6.7 |
9(>9溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是________(至少写一条)。
(2)调pH=8是为了除去________(填Fe3+、Al3+、Ca2+、Mg2+)。
(3)钠离子交换树脂的原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是_____(填Fe3+、Al3+、Ca2+、Mg2+)。
(4)试配平氧化还原反应方程式:□Na2Cr2O7+□SO2+□H2O = □Cr(OH)(H2O)5SO4+□Na2SO4;每生成1mol Cr(OH)(H2O)5SO4消耗SO2的物质的量为________。
(三)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合浊液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:①________;②________;③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)。
碳及其化合物有广泛的用途。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+ H2O(g)  CO(g) +H2(g)ΔH=" +131.3" kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是。(填序号)
CO(g) +H2(g)ΔH=" +131.3" kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是。(填序号)
| A.升高温度 | B.增加碳的用量 | C.加入催化剂 | D.用CO吸收剂除去CO |
(2)又知,C(s)+ CO2(g) 2CO(g) △H=+172.5kJ•mol-1
2CO(g) △H=+172.5kJ•mol-1
则CO(g)+H2O(g) CO2(g)+H2(g)的焓变△H=
CO2(g)+H2(g)的焓变△H=
(3)CO与H2在一定条件下可反应生成甲醇,CO(g)+2H2(g) CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为:。
CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为:。
若用该电池提供的电能电解60mLNaCl溶液,设有0.01molCH3OH完全放电,NaCl足量,且电解产生的Cl2全部溢出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=
(4)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
| 温度/℃ |
起始量/mol |
平衡量/mol[学科 |
达到平衡所x需时间/min |
||
| H2O |
CO |
H2 |
CO |
||
| 900 |
1.0 |
2.0 |
0.4 |
1.6 |
3.0 |
通过计算求出该反应的平衡常数(结果保留两位有效数字) 。
改变反应的某一条件,反应进行到tmin时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示) 。
(5)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为:N2(g)+3H2(g)  2NH3(g)ΔH=-92.4kJ•mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g)ΔH=-92.4kJ•mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
不同实验条件下反应,N2浓度随时间变化如下图1。

图1图2
请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为。
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在上图2中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
(1)双氧水的结构式为:;Ⅰ中发生反应的还原剂是 (填化学式)。
(2)Ⅱ中反应的离子方程式是 。
(3)A的化学式是 ,装置Ⅲ中A在 极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。
①写出该反应的化学方程式
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 (填相同、不相同或无法判断)
Ⅰ.
(1)某兴趣小组甲设计了以下装置和方法测定空气中SO2含量。你认为可行的操作是(填序号)
| 序号 |
A |
B |
C |
| 装置 |
 |
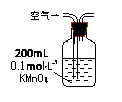 |
 |
| 原理 |
通入V升空气,测定生成沉淀的质量 |
当KMnO4溶液刚好褪色时,测定通入空气的体积V |
通入V升空气,测定U型管增加的质量 |
(2)兴趣小组乙取336mL(标准状况)某由SO2和N2组成的混合气体Y,将其通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中SO2的体积分数为
。
Ⅱ.某化学兴趣小组丙为探究Fe3+是否能氧化SO2,设计了如下实验装置。
(1)如上图连接好装置。实验前应进行操作
(2)观察到装置C中产生了白色沉淀,同学们提出了以下猜想(每个猜想只考虑一种物质的氧化性)。
猜想1: ;
猜想2:SO2被Fe3+氧化了;
猜想3:SO2被NO3—氧化了
(3)甲同学认为猜想1正确,并利用上述装置A进行了排除干扰的探究实验。
(4)乙同学认为猜想2正确,则装置C中反应的离子方程式是
(5)丙同学认为猜想3正确,他利用甲同学的实验装置,设计实验验证猜想。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:NaNO3溶液、KSCN溶液、FeCl3溶液、BaCl2溶液、
| 实验步骤 |
预期现象和结论 |
Fe(NO3)3溶液