常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HB物质的量浓度(mol/L) |
KOH物质的量浓度(mol/L) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c1 |
0.2 |
pH=7 |
| 丙 |
0.1 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
请回答下列问题:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HB是强酸还是弱酸________。
(2)不考虑其他组的实验结果,单从乙组情况分析,c1是否一定等于0.2 mol/L________?(填“是”或“否”)。混合溶液中离子浓度c(B-)与c(K+)的大小关系是________。
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,HB是________酸(填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol/L。写出该混合溶液中下列算式的精确结果(不能做近似计算),c(K+)-c(B-)=_mol/L。
现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水)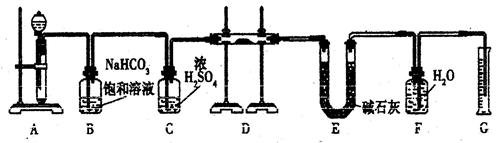
回答下列问题:
(1)装置A中液体试剂选用
(2)装置B的作用是。
装置E中碱石灰的作用是。
(3)装置D中发生反应的化学方程式是____________________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为。
(1)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
(1)+ +++H2O
+++H2O
(2)反应物中发生氧化反应的物质,被还原的元素是。
(3)反应中1 mol氧化剂得到mol电子。
铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3。回答下列问题
(1)沉淀物的化学式分别是:
a;d ;f 。
(2)写出加入试剂A时所发生主要反应的离子方程式
___________________________________________________________________________
(3)写出通入气体B时溶液c中发生反应的离子方程式
__________________________________________
(4) 气体B能否改用试剂A代替?为什么?
______________________________________________________________________
实验室用固体烧碱配制500mL 0.32mol·L-1的NaOH溶液。
①需称量______ ____ g的烧碱固体,固体应放在____________中置于天平左盘称量。
②配制过程中,不需要使用的仪器是(填符号)_____________。
A烧杯 B、量筒 C、玻璃棒 D、1000mL容量瓶 E、漏斗
③根据实验的实际需要和②中列出的仪器判断,完成实验还缺少的仪器是_________ (填仪器名称)。
④由于操作上的不规范,下列使所配溶液的物质的量浓度偏低的是_________:偏高的是______:
A称量时药品和砝码位置颠倒
B称量时间过长
C、溶液未冷却即转入容量瓶
D、容量瓶洗净后未烘干
E、定容时俯视刻度线
F、定容后倒转摇匀,发现液面低于刻度线而未加水补充
火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为。
(2)脱碳。将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)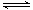 CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
①取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图所示,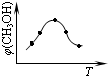
则上述CO2转化为甲醇的反应的△H3__________0(填“>”、“<”或“=”)。
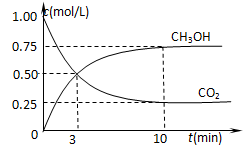
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示。试回答:0~10 min内,氢气的平均反应速率为mol/(L·min);该温度下,反应的平衡常数的值为;第10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时CH3OH(g)的体积分数(填变大、减少、不变)。
(3)脱硫。某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。硫酸铵和硝酸铵的水溶液的pH<7,其原因用离子方程式表示为;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na+) + c(H+)__________c(NO3-) + c(OH-)(填写 “>”“=”或“<”)