纯净物A、B、C、D、E均是中学常见 的物质。其转化关系如下图所示(图中某些生成物已略去),物质A与物质B之间的反应不在溶液中进行,通常状况下D为气体
的物质。其转化关系如下图所示(图中某些生成物已略去),物质A与物质B之间的反应不在溶液中进行,通常状况下D为气体


请回答下列问题:
( 1)若A、B、D均为短周期元素的单质,C为化合物且
1)若A、B、D均为短周期元素的单质,C为化合物且 气体D就是物质B,又知D气体不可燃,则B的分子式
气体D就是物质B,又知D气体不可燃,则B的分子式 是
是  ,化合物E的化学式为 。
,化合物E的化学式为 。
(2)若A、C、D均为短周期元素的单质,B、E为氧化物,且化合物E通常状况下为气体, 在一定条件下E还可以和氧气发生反应。则A位于在周期表中的 周期 族。A和
在一定条件下E还可以和氧气发生反应。则A位于在周期表中的 周期 族。A和 B反应生成C的化学方程式是 。
B反应生成C的化学方程式是 。
有机物F是一种新型涂料固化剂,可由下列路线合成(部分反应条件略去):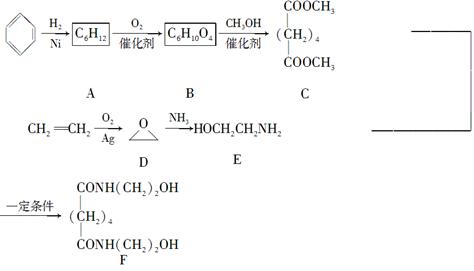
(1)B的结构简式是________;E中含有的官能团名称是________。
(2)由C和E合成F的化学方程式是________。
(3)同时满足下列条件的苯的同分异构体的结构简式是________。
①含有3个双键 ②核磁共振氢谱只显示1个吸收峰
③不存在甲基
(4)乙烯在实验室可由________(填有机物名称)通过________(填反应类型)制备。
(5)下列说法正确的是________。
a.A属于饱和烃
b.D与乙醛的分子式相同
c.E不能与盐酸反应
d.F可以发生酯化反应
下列是利用烃C3H6合成有机高分子E和烃C6H14的流程图。请回答以下问题: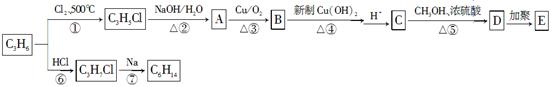
(1)①~⑥中属于取代反应的有________。
(2)C6H14的核磁共振氢谱只有两种峰,则C6H14的结构简式为________________;写出E的结构简式:__________________。
(3)写出B与新Cu(OH)2反应的化学方程式:________________。
(4)D的同分异构体很多,符合下列条件的同分异构体有________种,其中氢原子核磁共振氢谱谱峰最少的结构简式为________。
①含碳碳双键 ②能水解 ③能发生银镜反应
(5)根据你所学知识和上图中相关信息,以乙醇为主要原料通过三步可能合成环己烷(无机试剂任选),写出第一步和第三步化学反应的化学方程式(有机物质写结构简式):________、________。
甲元素的原子序数是11,乙元素原子核外有两个电子层,最外电子层上有6个电子;丙是元素周期表第ⅠA族中金属性最弱的碱金属元素。由此推断:
(1)甲元素在周期表中位于第________周期;乙元素在周期表中位于第________族;丙元素的名称为________。
(2)甲的单质与水反应的离子方程式为__________________________。乙单质与丙单质反应的化学方程式为______________________________________________________。
在1961年,本生和基尔霍夫发现了一种新的碱金属元素,根据已学知道解答下列问题,帮助这两位科学家研究该元素。
(1)该元素单质的密度比水的密度大,则该元素可能是_______________________________。
(2)该元素的单质与水反应比钾与水反应剧烈,但没有铯与水反应剧烈,由此可确定该元素是________。其确定依据是_____________________________________________________。
(3)人类制备出该元素的单质比钠单质要晚得多,分析其中的原因:__________________。
某学生往一支试管里按一定次序分别加入下列几种物质:
| A.KI溶液, | B.淀粉溶液, | C.NaOH溶液, | D.氯水。发现溶液颜色按下面次序变化: |
①无色―→②棕黄色―→③蓝色―→④无色。
依据溶液颜色的变化回答下列问题:
(1)加入以上药品的顺序是_________________________________________________。
(2)写出①→②的离子反应方程式,若为氧化还原反应,请标明电子转移的方向和总数:_______________________________________________________________________。
(3)写出③→④的化学反应方程式:___________________________________________。