(15分)乙苯催化脱氢制苯乙烯反应:
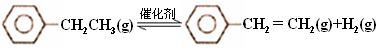
(1)已知:
| 化学键 |
||||
| 键能/ | 412 |
348 |
612 |
436 |
计算上述反应的=
(2)维持体系总压强恒定,在温度时,物质的量为、体积为的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为,则在该温度下反应的平衡常数=
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了以外的产物中苯乙烯的物质的量分数)示意图如下:
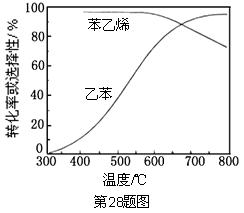
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实
②控制反应温度为600℃的理由是
(4)某研究机构用代替水蒸气开发了绿色化学合成工艺--乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:,。新工艺的特点有
① 与反应,使乙苯脱氢反应的化学平衡右移
② 不用高温水蒸气,可降低能量消耗
③ 有利于减少积炭
④ 有利于资源利用
工业上生产高氯酸(沸点:90oC)时还同时生产了亚氯酸钠,其工艺流程如下: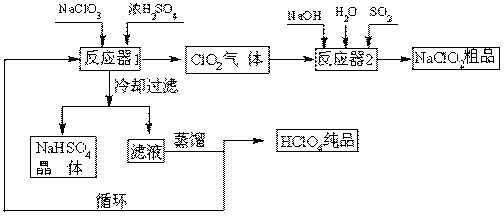
(1)冷却过滤的目的。
(2)通入反应器2的SO2作用是;反应器2中发生反应的离子方程式为。
(3)循环使用的物质是。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是。
(5)通过电解NaClO3水溶液的方法也可以制备NaClO4,进而可以制备HClO4,写出阳极的电极反应式。
氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300-1700oC的氮气流中反应制得3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)上述反应氧化剂是,已知该反应每转移1mole—,放出132.6kJ的热量,该方程式的∆H =。
(2)能判断该反应(在体积不变的密闭容器中进行)已经达到平衡状态的是()
A.焦炭的质量不再变化 B.N2和CO速率之比为1:3
C.生成6molCO同时消耗1mol Si3N4 D.混合气体的密度不再变化
(3)下列措施中可以促进平衡右移的是()
A.升高温度 B.降低压强
C.加入更多的SiO2 D.充入N2
(4)该反应的温度控制在1300-1700oC的原因是。
(5)某温度下,测得该反应中N2和CO各个时刻的浓度如下,求0—20 min内N2的平均反应速率,该温度下,反应的平衡常数K=。
| 时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
| N2浓度/mol·L-1 |
4.00 |
3.70 |
3.50 |
3.36 |
3.26 |
3.18 |
3.10 |
3.00 |
3.00 |
3.00 |
| CO浓度/mol·L-1 |
0.00 |
0.90 |
1.50 |
1.92 |
2.22 |
2.46 |
2.70 |
— |
— |
— |
咖啡酸(见右),存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等。咖啡酸有止血作用,特别对内脏的止血效果较好。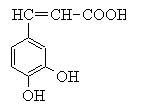
(1)咖啡酸的化学式是,咖
啡酸中含氧官能团的名称为 。
(2)咖啡酸发生加聚反应的化学方程式。
(3)下列关于咖啡酸的说法正确的是()
| A.1mol咖啡酸只与1mol溴反应 |
| B.咖啡酸有一种同分异构体的苯环上连4个羟基 |
| C.咖啡酸的水溶液中滴加氯化铁溶液显血红色 |
| D.可以用高锰酸钾或溴水检验咖啡酸分子中所含的碳碳双键 |
(4)写出1分子咖啡酸与2分子CH3COCl在一定条件下发生反应生成酯的方程式
。
(5)A是咖啡酸的一种同分异构体,A中苯环上的取代基仅1个,1molA能与2molNaHCO3反应,A的结构简式为。
反应① Fe(s)+CO2(g)===FeO(s)+CO(g);△H1=" a" kJmol-1
反应② CO(g)+1/2O2(g)===CO2(g);△H2=" b" kJmol-1
测得在不同温度下,在密闭容器中进行的反应①的平衡常数K值随温度的变化如下:
(1)反应①的化学平衡常数表达式为,a0(填“> ”、“<”或“="”)。" 在 500℃2L 密闭容器中进行反应①,Fe 和 CO2的起始物质的量均为4mol,10min后达到平衡状态,平衡时CO2的转化率为,用CO表示的化学反应速率为。
”、“<”或“="”)。" 在 500℃2L 密闭容器中进行反应①,Fe 和 CO2的起始物质的量均为4mol,10min后达到平衡状态,平衡时CO2的转化率为,用CO表示的化学反应速率为。
(2)700℃反应①到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有(填序号)。
| A.缩小反应器体积 | B.通入CO2 | C.升高温度到900℃ | D.使用合适的催化剂 |
(3)下列图像符合反应①的是(填序号)(图中v是速率、 为混合物中CO的含量,T为温度)。
为混合物中CO的含量,T为温度)。
(4)由反应①和②可求得反应2Fe(s)+O2(g)===2FeO(s) △H3中的△H3=(用含a、b的代数式表示)。
(5)如下图是甲醇燃料电池(电解质溶液为KOH溶液)的结示意图,则a处通入的是
(填“甲醇”或“氧气”),b处电极上发生的电极反应是:
有一瓶澄清的溶液,其中可能含有NH4+、K+、Ba2+、Al3+、Fe3+、 I-、NO3-、CO32-、SO42-、AlO2-。取该溶液进行以下实验:
①用pH试纸检验,溶液呈强酸性。
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色。
③另取溶液适量,逐滴加入NaOH溶液,现象如下:
a.溶液从酸性变为中性;b.溶液逐渐产生沉淀;c.沉淀逐渐溶解,直至消失;
d.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
④取适量③得到的碱性溶液加入Na2CO3溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题。
(1)仅由③可证明离子存在;写出c、d所涉及的化学反应方程式,是离子反应的用离子方程式表示:
c_______________;d________________。
(2)综合判断填空:
①上述澄清溶液中一定存在的离子有
②可能存在的离子有,检验该离子是否存在的方法为