【化学——选修3:物质结构与性质】
Ⅰ.顺铂是美国教授B Rosenberg等人于1969年发现的第一种具有抗癌活性的金属配合物,它的化学式为Pt(NH3)2Cl2。
(1)与氮元素处于同一周期且相邻的两种元素分别是 ,这三种元素的第一电离能由大到小的顺序是 ,电负性由小到大的顺序是 。
(2)与NH3互为等电子体的分子、离子有 、 (各举一例)。
(3)碳铂是1,1-环丁二羧酸二氨合铂(Ⅱ)的简称,是第二代铂族抗癌药物,其毒副作用低于顺铂。碳铂的结构如图: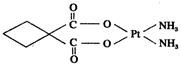
碳铂分子中含有的作用力有 (填字母)。
| A.极性共价键 | B.非极性共价键 | C.配位键 | D.离子键 |
E.金属键 F. 键 G.
键 G.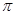 键
键
(4)碳铂中C原子的杂化方式有 。
(5)铂(Pt)单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。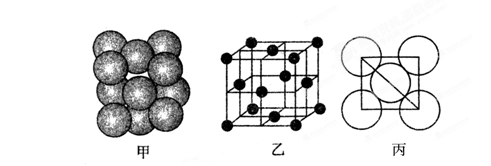
晶胞中铂(Pt)原子的配位数为 。若已知铂(Pt)的摩尔质量为M g/mol,阿伏加德罗常数为NA,Pt原子半径为b pm,则该晶胞的密度为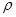 = g/cm3。(用含M、NA、b的计算式表示,不用化简)。
= g/cm3。(用含M、NA、b的计算式表示,不用化简)。
Ⅱ.原子序数小于36的元素A和B,在周期表中既处于同一周期又位于同一族,且原子序数B比A多1,基态B原子中含有三个未成对电子,B元素在周期表中的位置为 ,A2+在基态时外围电子(价电子)占据的能层符号为 ,外围电子(价电子)排布式 。
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置(图3)。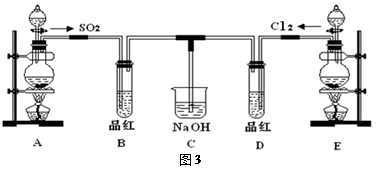
(1)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B:________________________________,D:____________________________。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B:________________________________,D:____________________________。
(2)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象那样。请你分析该现象的原因(用化学方程式表示)______________________________。
(3)装置E中用MnO2和浓盐酸反应制得Cl2,若反应生成的Cl2体积为2.24L(标准状况),则被氧化的HCl为mol。
(4)实验结束后,有同学认为装置C中可能含有SO32-、SO42-、Cl-、OH-等阴离子,请填写检验其中SO42-和SO32-的实验报告。
限选试剂:2 mol·L-1 HCl;1 mol·L-1 H2SO4;l mol·L-1 BaCl2;l mol·L-1MgCl2
1 mol·L-1 HNO3;0.1 mol·L-1 AgNO3;新制饱和氯水。
| 编号 |
实验操作 |
预期现象和结论 |
| 步骤① |
取少量待测液于试管中,滴入 至过量 |
,证明待测液中含SO32-。 |
| 步骤② |
在步骤①的溶液中滴入少量 |
, 证明待测液中含SO42-。 |
某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图(2)所示。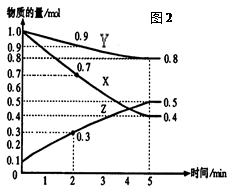
(1)由图中的数据分析,该反应的化学方程式为。
(2)反应开始至5min,Z的平均反应速率为;
(3)反应开始至5min ,正反应速率逐渐;逆反应速率逐渐, 5min后Z的物质的量不再改变,原因是下列的;
A.正逆反应都停止了
B.正反应速率为零
C.正逆反应速率相等,反应达到平衡状态
D.逆反应速率为零
(4)下列措施能使正反应速率增大的是
A.升高温度 B.降低温度
C.增大Y的浓度 D.减少Z的浓度
X、Y、Z是三种短周期元素。已知三种元素的原子序数按X、Y、Z的顺序依次增大,且原子序数之和为33,最外层电子数之和为11。在周期表中,X、 Z上下相邻,Y、Z左右相邻。
(1)X、 Y、Z的元素符号分别为、、。
(2) Y的氧化物是性氧化物,X、Z的最高价氧化物的水化物酸性强弱为>
(填物质的化学式)。
(3) X和Z分别能与氧形成XO2和ZO2,XO2在固态时属于晶体,ZO2在固态时属于晶体;XO2的电子式为。
(4)Y的最高价氧化物的水化物与氢氧化钠溶液反应的离子方程式为。
根据铜锌原电池示意图,回答下列问题:
(1)锌为极,电极反应式为;铜为极,电极反应为,原电池总离子反应式是。
(2)若以该电池作为电源,以石墨碳棒为电极电解CuCl2溶液,在电池的工作过程中,Zn极质量变化了3.25g,则Cu极质量(填“增加”、“不变”或“减少”);电子从电池的锌极沿导线流向电解池的(填“阴极”或“阳极”,下同);在电解池中Cu2+向移动,在该电极上析出铜的质量为g。
(14分)阅读并完成以下各项内容:
SO2是常见的大气污染物之一,我国规定空气中SO2含量不得超过0.02 mg/L。
(1)酸雨是降水呈酸性(pH小于5.6)的统称,个别地方甚至低于2.1(食醋的pH=3)。引起酸雨的罪魁祸首是大气中的SO2和氮的氧化物。它们的主要来源是煤和石油的燃烧,全世界每年排放1.5亿吨的SO2。
①SO2可在空气中受光照等因素作用而被氧化,最终与雨水形成硫酸型酸雨。试写出这两个化学反应的方程式:________________ ,。
②汽车排放的尾气、硝酸厂和化肥厂的废气中都含有氮的氧化物,全世界每年排放量约为5×107 kg。NO2溶于水生成 ________和NO。
③酸雨可导致的危害有________(填序号)。
A.腐蚀建筑物 B.导致树木枯萎 C.造成洪涝灾害 D.恶化人类环境
④为了减少酸雨的形成,必须减少SO2的排放量,对燃料中的硫化物进行________,对废气中的氮的氧化物用________吸收。
(2)某化学兴趣小组选用下图实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量(已知碘能氧化H2SO3,生成H2SO4)。
①若原料气从左向右流时,上述装置连接的顺序是:原料气→________ (用字母和箭头表示)。
②装置②中发生反应的离子方程式为:;
当装置②中出现________现象时,立即停止通气。
③你认为下列试剂中,可以用来代替试管中的碘的淀粉溶液的是________。
A.酸性KMnO4溶液 B.NaOH溶液 C.溴水 D.氨水