铝和氢氧化钾都是重要的工业产品,请回答问题:
(1)金属铝的生产是以Al2O3为原料,在熔融状态下进行电解,化学方程式为

电极均由石墨材料做成,电解时不断消耗的电极是____________(填“阴极”或“阳极”),
原因是__________________________ (用化学方程式表示)。
(2)对铝制品进行抗腐蚀处理,可延长其使用寿命。以处理过的铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为____________________ 。
(3)铝电池性能优越,Al—Ag2O电池可用作水下动力电源,化学反应为

则负极的电极反应式为______________,正极附近溶液的碱性______(填“增强”、“不变”或“减弱”)。
(4)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。

①该电解槽的阳极反应式是 。
②阴极区碱性增强的原因是
③除去杂质后的氢氧化钾溶液从液体出口 (填写“A”或“B”)导出。
(14分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| A |
|||||||||||||||||
| B |
C |
D |
E |
F |
|||||||||||||
| G |
H |
I |
J |
K |
L |
||||||||||||
| M |
N |
||||||||||||||||
试回答下列问题:
(1)请写出元素N的基态原子电子排布式________________________________。
(2)ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是__________(填“极性”或“非极性”)分子。
(3)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有___________(填序号),CS2分子的空间构型是__________。
(4)元素N可以形成分子式为Co(NH3)5BrSO4,配位数均为6的两种配合物,若往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则该配合物的化学式为_____________________。SO42-的空间构型是_________________其中S原子的杂化类型是_________________
第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
请回答以下问题:
⑴认真分析上图中同周期元素第一电离能的变化规律,将Na——Ar之间六种元素用短线连接起来,构成完整的图像。
⑵从上图分析可知,同一主族元素原子的第一电离能I1变化规律是____________;
⑶上图中5号元素在周期表中的位置是__________________________;
⑷上图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:_________________________________________________。
(5)同周期内,随原子序数增大,I1值增大。但个别元素的I1值出现反常现试预测下列关系式中正确的是__________。
①E(砷)>E(硒)②E(砷)<E(硒)③E(溴)>E(硒)④E(溴)<E(硒)
(6)用氢键表示式写出HF溶液中存在的所有氢键_________________________________
联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
(1)已知:2NO2(g)===N2O4(g)△H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是 (填字母)。
N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是 (填字母)。
| A.减小NO2的浓度 | B.降低温度 |
| C.增加NO2的浓度 | D.升高温度 |
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H=kJ·mol-1。
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)="0.0300" mol·L-1、c(N2O4)="0.0120" mol·L-1。则此温度下平衡常数K=____________
如下图所示的装置,C、D、E、F都是惰性电极。将电源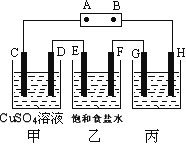 接通后,向乙中滴入酚酞液,在F极附近显红色。试回答:
接通后,向乙中滴入酚酞液,在F极附近显红色。试回答:
(1)电源的A极是_______;
(2)写出甲装置中电解反应的总方程式:_________;
(3)如果收集乙装置中产生的气体,EF两电极产生的气体的体积比是______________;
(4)欲用丙装置给铜镀银,G应该是_______(填化学式)
(5)若乙装置共收集到标况下448mL气体,则H电极质量变化_________g
有机分子中,不同氢原子在NMR中对应不同的峰(信号),且峰的强度与分子中同类氢原子个数成正比。例如丙烷分子有两种不同的H(甲基中的H和亚甲基中的H),NMR有两个峰,且两个峰的强度比为6∶2(或写成3∶1,前者为甲基上氢对应的峰,后者为亚甲基上氢对应的峰);同理,甲醇分子的PMR有两个峰,且强度比为3∶1。
⑴苯甲酸(-COOH)分子的PMR有个峰。
⑵ 在运用NMR谱确定C3H6O结构时,在核磁共振谱上给出的峰有两组其中一组只有一个信号峰,该组信号峰对应物质的结构简式为,另一组有三个信号峰,则三个信号峰的强度比为,分析中还发现一组也有三个信号峰,三个信号峰的强度比为1:1:4,则该物质的结构简式可能为