(18分)1923年以前,甲醇一般是用木材或其废料的分解蒸馏来生产的。现在工业上合成甲醇几乎全部采用一氧化碳或二氧化碳加压催化加氢的方法,工艺过程包括造气、合成净化、甲醇合成和粗甲醇精馏等工序。
已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:

(1)反应②有焓变△H 0。
(2)反应①在实际生产过程中可用用天然气和水制取原料气的方程式为: 。
某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如下图所示。则平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”)。

据反应①与②可推导出K1、K2与K3之间的关系,则K3=_________(用K1、K2表示)
(3)在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如下图所示,若在t0时刻分别改变一个条件,则曲线Ⅰ可变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是_____________。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是________。

(4)甲醇燃料电池有着广泛的用途,若采用铂为电极材料,两极上分别通入甲醇和氧气,以氢氧化钾溶液为电解质溶液,则该碱性燃料电池的负极反应式是_________________;若电池放电后溶液中溶质只有K2CO3,溶液中离子浓度由大到小的顺序为:_________________;
(5)一定条件下甲醇与一氧化碳反应可以合成醋酸。通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为_____________。
.1-20号元素(稀有气体元素除外)中(填元素符号):
⑴原子半径最 小的元素是,原子半径最大的元素是
小的元素是,原子半径最大的元素是
⑵与水反应最剧烈的金属单质是,非金属 单质是
单质是
⑶既能与酸反应,又能与碱反应的金属单质是
⑷硬度最大的单质是
⑸气态氢化物的水溶液酸性最强的元素是
高炉炼铁过程中发生的主要反应为: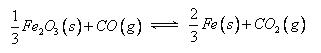
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
4.0 |
3.7 |
3.5 |
已知该反应在不同温度下的平衡 常数如下:
常数如下:
请回答下列问题:
(1) 该反应的平衡常数表达式K=_____________,△H______0(填“>”、“<”或“=”);
(2) 在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,
反应经过l0min后达到平衡。求该时间范围内反应的平均反应速率υ(CO2)=
依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_________________________________________。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学方程式:
Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g)△H=- A kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g)△H=- B kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g)△H= + C kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学方程式:
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: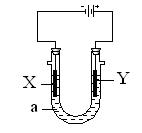
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则①电解池中X极上的电极反应式是。在X极附近观察到的现象是。② Y电极上的电极反应式是,检验该电极反应产物的方法是。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
X电极的材料是,电极反应式是。
(说明:杂质发 生的电极反应不必写出)
生的电极反应不必写出)
.根据下面的反应路线及所给信息填空: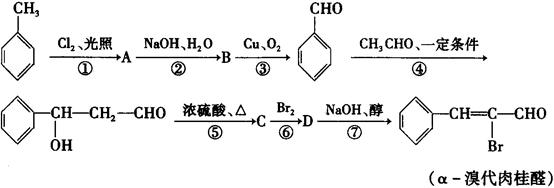
(1) 反应①的类型是________,反应⑥的类型是___________
(2)C的结构简式是_____________,D的结构简式是_________________
(3)写出反应②的化学方程式
(4)反应⑦中,除生成α-溴代肉桂醛的同时,还有可能生成其他有机物,
请写出其结构简式, .