(1)下列五种物质中①Ar、②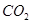 、③
、③ 、④NaOH、⑤
、④NaOH、⑤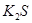 ,只存在共价键的是 (填序号,下同),只存在离子键的是 ,既存在离子键又存在共价键的是 ,不存在化学键的是 。
,只存在共价键的是 (填序号,下同),只存在离子键的是 ,既存在离子键又存在共价键的是 ,不存在化学键的是 。
(2)在以下过程中:①碘的升华、②烧碱熔化、③氯化铵受热分解、④石英熔化、⑤氯化钠溶于水、⑥氯化氢溶于水、⑦氧化钠溶于水、⑧碘溶于四氯化碳,未发生化学键破坏的是
(填序号,下同),仅发生离子键破坏的是 ,仅发生共价键破坏的是 ,既发生离子键破坏、又发生共价键破坏的是 。
减少污染、保护环境是全世界最热门的课题。
(1)为了减少空气中SO2的排放,常采取的措施有:
将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)==H2O(g)ΔH1=-241.8 kJ·mol-1
C(s)+1/2O2(g)===CO(g)ΔH2=-110.5 kJ·mol-1
则焦炭与水蒸气反应生成CO的热化学方程式为:_________________________。
(2)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g)  CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
①M、N两点平衡状态下,容器中总物质的物质的量之比为:n(M)总:n(N)总=。
②若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为。
(3)电化学降解NO—的原理如图所示,电源正极为(填“a”或“b”);若总反应为4NO3-+4H+ 5O2↑+2N2↑+2H2O,则阴极反应式为_________________。
5O2↑+2N2↑+2H2O,则阴极反应式为_________________。
(4)已知25 ℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.5×10-10。现向1000 L 1.5×10-2mol/L CaCl2溶液中通入氟化氢气体,当开始出现白色沉淀时,通入的氟化氢为____________ mol(保留3位有效数字)。
(1)某温度时,在3 L密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示,由图中数据分析:
①该反应的化学方程式为:____________________。
②反应开始至2 min末,X的反应速率为________。
③该反应是由________________开始反应的(填“正反应”、“逆反应”或“正、逆反应同时”)。
(2)对于上述反应NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1在密闭容器中将过量NH2CO2NH4固体于400K下分解,平衡时体系压强为a Pa,若反应温度不变,将体系的体积增加50%,则体系的压强是Pa(用含a的式子表示)。
CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1在密闭容器中将过量NH2CO2NH4固体于400K下分解,平衡时体系压强为a Pa,若反应温度不变,将体系的体积增加50%,则体系的压强是Pa(用含a的式子表示)。
如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时,V(A)=V(B)=a L。在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:
X+Y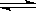 2Z+W△H<0(X、Y、Z、W均为气体),
2Z+W△H<0(X、Y、Z、W均为气体),
达到平衡时,V(A)=1.2aL,试回答:
(1)A中X的转化率α(A)=________;
(2)A、B中X转化率的关系:α(A)_________ α(B)(填“>”、“=”“<”);
(3)打开K,一段时间又达到平衡时,A的体积为_______L(连通管中气体体积不计)
反应aA(g)+bB(g)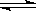 cC(g)+dD(g)在容积不变的密闭容器中达平衡,且起始时A和B的物质的量之比为a:b,则:
cC(g)+dD(g)在容积不变的密闭容器中达平衡,且起始时A和B的物质的量之比为a:b,则:
(1)平衡时,A、B转化率之比是_________。
(2)若同等倍数地增大A、B的物质的量浓度,使A与B转化率同时增大,(a+b)与(c+d)所满足的关系是___________。
(3)若a="2" b="1" c="3" d=2在甲、乙、丙、丁4个容器中A的物质的量依次是2mol、1mol、2mol、1mol,B物质的量依次是1mol、1mol、2mol、2mol,C、D物质的量均为0,则在同条件下达平衡时B的转化率由大→小顺序_________,A的转化率由大→小顺序__________。
在一定条件下,将2molA和2molB混合于容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)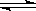 xC(g)+2D(g)。2min末反应达到平衡状态时,生成0.8molD,同时测得C的浓度为0.4mol/L。请填写下列空白:
xC(g)+2D(g)。2min末反应达到平衡状态时,生成0.8molD,同时测得C的浓度为0.4mol/L。请填写下列空白:
(1)x=______;用D的浓度变化表示的化学反应速率为_____________。
(2)A的平衡浓度为_______,B的转化率为__________。
(3)如果增大体系的压强,则平衡体系中C的体积分数将____(填“增大”“减小”或“不变”)。
(4)如果上述反应在相同条件下从逆反应开始进行,起始时加入C和D各 mol,要使平衡时各物质的体积分数与原平衡时完全相同,则还应加入______物质________mol。
mol,要使平衡时各物质的体积分数与原平衡时完全相同,则还应加入______物质________mol。