(18分)NOx、SO2是主要的大气污染物,科学处理这些污染物对改善人们的生存环境具有重要的现实意义。
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ•mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ•mol-1
则CH4与NO反应生成N2与CO2的热化学方程式为:______________________________________。
(2)利用氧化氮氧化物的流程如下:
写出反应Ⅱ的化学方程式 ________________;已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应Ⅱ中生成N2的体积(标准状况下)为2.24L,则反应I中转移电子的物质的量为_________,还原剂的质量为_________。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水电离出的OH‾浓度_________(填“增大”、“减小”或“不变”);试计算溶液中  。
。
(常温下H2SO3的电离常数: )
)
(4)利用Fe2(SO4)3溶液也可处理SO2废气,其流程如下图所示。
①简述用Fe2(SO4)3晶体配制溶液A的方法__________________。
②写出向溶液A中通入含SO2废气反应的离子方程式______________________________。
③设计实验验证溶液B是否仍具有处理废气的能力,简述实验的操作、现象和结论________________。
(3分)肉桂醛的结构为: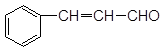
①把足量肉桂醛加入到溴水中,溴水褪色了,这____________(填“能”或“不能”)说明肉桂醛中存在碳碳双键。
②检验分子中碳碳双键的方法是_______________。
(3分)在硫酸铜溶液中加入过量的氢氧化钠溶液后,再滴入足量乙醛溶液,加热。实验过程中发生的反应的化学方程式为。
(l)常温下,如果取0.1mol•L﹣1HA溶液与0.1mol•L﹣1NaOH溶液等体积混合,测得混合液的pH=8.混合液中由水电离出的OH﹣浓度与0.1mol•L﹣1NaOH溶液中由水电离出的OH﹣浓度之比为_________ .
(2)相同温度下,将足量硫酸钡固体分别放入相同体积的①0.1mol•L﹣1硫酸铝溶液 ②0.1mol•L﹣1氯化钡溶液 ③蒸馏水 ④0.1mol•L﹣1硫酸溶液中,Ba2+浓度由大到小的顺序是_________ .(用序号填写)
(3)常温下,将a mol•L﹣1的氨水与0.1mol•L﹣1的盐酸等体积混合,当溶液中c(NH4+)=c(Cl﹣)时,用含a的代数式表示NH3•H2O的电离常数Kb= _________ mol•L﹣1.
在标准状况下,取甲、乙、丙各30.0mL 相同浓度的盐酸,然后分别慢慢加入组成相同的镁铝合金粉末,得下表中有关数据(假设反应前后溶液体积不发生变化):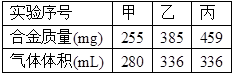
请回答:
(1)甲组实验中,盐酸(选填“过量”、“适量”或“不足量”,下同)__________________;乙组实验中盐酸______________。
(2)盐酸的物质的量浓度为_____________。
(3)合金中Mg. Al 的物质的量之比为_______________。
下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:(无特殊说明均填元素符号、化学式等化学用语)
| 主族 周期 |
IA |
ⅡA |
IIIA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 1 |
① |
|||||||
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|||
| 4 |
⑩ |
(1)在这些元素中,化学性质最不活泼的元素名称是,元素原子半径最小的是,⑧号元素的离子结构示意图为。
(2)在上述元素的最高价氧化物对应水化物中,酸性最强的化合物的化学式是,碱性最强的化合物的化学式是,既能与强酸反应,又能与强碱反应的化合物的化学式是。
(3)⑧、⑨号元素的氢化物中还原性较强的是(填化学式)。
(4)⑦的最高价氧化物与⑤的最高价氧化物对应的水化物反应的化学方程式为:_______。
(5)写出能说明⑨的非金属性比⑧强的一个实验事实________________________________。