下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:(无特殊说明均填元素符号、化学式等化学用语)
| 主族 周期 |
IA |
ⅡA |
IIIA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 1 |
① |
|
|
|
|
|
|
|
| 2 |
|
|
|
|
② |
③ |
|
④ |
| 3 |
⑤ |
⑥ |
⑦ |
|
|
⑧ |
⑨ |
|
| 4 |
⑩ |
|
|
|
|
|
|
|
(1)在这些元素中,化学性质最不活泼的元素名称是 ,元素原子半径最小的是 ,⑧号元素的离子结构示意图为 。
(2)在上述元素的最高价氧化物对应水化物中,酸性最强的化合物的化学式是 ,碱性最强的化合物的化学式是 ,既能与强酸反应,又能与强碱反应的化合物的化学式是 。
(3)⑧、⑨号元素的氢化物中还原性较强的是 (填化学式)。
(4)⑦的最高价氧化物与⑤的最高价氧化物对应的水化物反应的化学方程式为:_______。
(5)写出能说明⑨的非金属性比⑧强的一个实验事实________________________________。
现有以下物质:①铁②空气 ③CaCO3固体④CuSO4·5H2O晶体
⑤K2SO4溶液⑥酒精(C2H5OH) ⑦熔融NaOH。请回答下列问题(填序号):
(1)以上物质属于混合物的有________;
(2)以上物质属于盐的是________;
(3)以上物质属于电解质的是________;
(4)写出⑤中溶质的电离方程式。
(1)已知完全断裂1 mol氮气中的键需要吸收热量946kJ,完全断裂1 mol氢气中的键需要吸收热量436KJ,根据热化学方程式: N2(g) + 3H2(g)="=" 2NH3(g) △H=-92.4kJ·mol-1
则氨气中1molN—H键断裂时吸收热量是_______ kJ。
(2)0.2mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态的三氧化二硼和液态水,放出433kJ热量,其热化学方程式为______________________________________
又已知:H2O(l)===H2O(g)ΔH=+44 kJ·mol-1。则5.6 L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是__________kJ。
某温度时,在2 L的密闭容器中,M、N两种物质的量随时间的变化曲线如下图所示。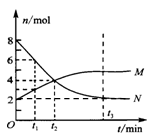
(1)达到平衡时N的转化率是
(2)由图中所给数据进行分析,该反应的化学方程式为;
(3)若t2=2,则反应从开始至2分钟末,用M的浓度变化表示的平均反应速率为 v(M)=;
某有机物A经分析,含碳的质量分数为90%,含氢的质量分数为10% 。其蒸气相对于氢气的密度为60,则:
(1)有机物A的分子式为:
(2)经红外光谱测知A为苯的同系物,且核磁共振氢谱峰面积比为3:2:2:2:3,则其结构简式为:
(3)有机物A在一定条件下有下列转化关系:
请回答:
①D中含氧官能团名称:
②B→F的反应类型:,高分子化合物H的结构简式:
③E→G的化学方程式:
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。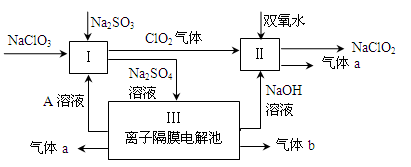
(1)Ⅰ中发生反应的还原剂是(填化学式)。
(2)Ⅱ中反应的离子方程式是。
(3)A的化学式是,气体b的化学式是,装置Ⅲ中发生反应的化学方程式是。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2 + 4HCl =" 5NaCl" + 4ClO2↑ + 2H2O。
①该反应中氧化剂和还原剂的物质的量之比是。
②研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是。