某温度时,在2 L的密闭容器中,M、N两种物质的量随时间的变化曲线如下图所示。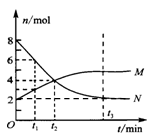
(1)达到平衡时N的转化率是
(2)由图中所给数据进行分析,该反应的化学方程式为 ;
(3)若t2=2,则反应从开始至2分钟末,用M的浓度变化表示的平均反应速率为 v(M)= ;
南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为28(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请思考下列问题:
(1)该泉水属于_________硬水(填写“暂时”或“永久”)。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂添加时先加________ 后加________,原因是_____________________________________________________________。
(3)目前常用阳离子交换树脂如NaR、HR来进行水的软化,若使用HR作为阳离子交换树脂,则水中的Ca2+、Mg2+与交换树脂的________起离子交换作用。若使用NaR作为阳离子交换树脂,失效后可放入5%~8%_____________溶液中再生。
(4)岛上还可以用海水淡化来获得淡水。下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题: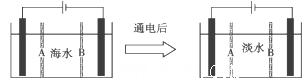
①阳离子交换膜是指______________(填A或B)。
②写出通电后阳极区的电极反应式:_____________________________.
阴极区的现象是:_______________________________________________.
现有0.175mol/L醋酸钠溶液500mL(已知醋酸的电离常数Ka=1.75x10 )
)
(1)写出醋酸钠水解反应的化学方程式_____________________。
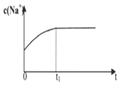
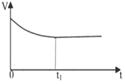
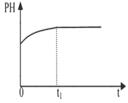
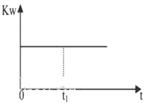
(2)下列图像能说明醋酸钠的水解反应达到平衡的是_____________________。
 |
 |
 |
 |
| A.溶液中c (Na+)与反应时间t的关系 |
B.CH3COO-的水解速率与反应时间t的关系 |
C.溶液的PH与反应时间t的关系 |
D.KW与反应时间t的关系 |
(3)在醋酸钠溶液中加入下列少量物质,水解平衡向正反应方向移动的有
A.冰醋酸 B.纯碱固体 C.醋酸钙固体 D.氯化铵固体
(4)在醋酸钠溶液中加入少量冰醋酸后,溶液中微粒浓度的关系式能成立的有
A.c(CH3COO-)+c(CH3COOH)>c(Na+)
B.c(Na+)+c(CH3COO-)>c(H+)>c(OH-)
C.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.c(CH3COO-)>c(H+)>c(OH-)>c(Na+)
(5)欲配制0.175mol/L醋酸钠溶液500mL,可采用以下两种方案:
方案一:用托盘天平称取_______g无水醋酸钠,溶于适量水中,配成500mL溶液。
方案二:用体积均为250 mL且浓度均为________的醋酸与氢氧化钠两溶液混合而成(设混合后的体积等于混合前两者体积之和)。
(6)在室温下,0.175mol/L醋酸钠溶液的PH约为________(已知醋酸根的水解反应的平衡常数K=Kw/Ka(CH3COOH))。
(一)在含有物质的量各为0.1 mol FeCl3、H2SO4、Cu(NO3)2的溶液500 mL中,逐渐加入铁粉,溶液中n(Fe2+)与加入n(Fe)的关系如图A(请注意识图,该题图中每小正方格长度为0.05mol)。(提示:忽略离子水解产生的影响;如果有硝酸根被还原时,则生成一氧化氮气体)
(1)写出图中n(Fe)从0.125mol-0.225 mol段对应反应的离子方程式____。
(2)写出图中n(Fe)从0-0.05 mol段对应反应的离子方程式____。
(3)请在图B中画出溶液中n(Fe3+)与加入n(Fe)的变化关系图
(4)当反应进行到最后,取该溶液2mL加入试管中,为了证明该溶液中有NO3-存在,可以向试管中在滴加_______。
| A.酸性KMnO4溶液 | B.含有盐酸的KSCN溶液 | C.碘水 | D.次氯酸钠溶液 |

(二)下图是电解槽的剖面图,箭头的方向指的是气体或溶液的流向,阳离子交换膜只允许阳离子通过。现要用此装置来通过电解分离Na2SO4和NaOH的混合溶液,则向装置中通入A1溶液和A2溶液(A1溶液是Na2SO4和NaOH的混合溶液,A2溶液是NaOH的稀溶液)。电解一段时间后,装置中流出:B2溶液(是NaOH的浓溶液)和B1溶液,C1气体和C2气体。
(1) C2气体是______(填化学式)。
(2)请写出阳极反应的电极方程式.
(3)请简述阴极室能流出NaOH的浓溶液的原因.
X、Y、Z、W均为10电子的分子或离子。X有5个原子核。通常状况下,W为无色液体。它们之间转化关系如图所示,请回答: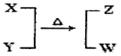
(1)工业上每制取1molZ要放出46.2 kJ的热量,写出该反应的热化学方程式:。
(2)工业制取Z的化学平衡常数K与T的关系如下表:
| T/K |
298 |
398 |
498 |
…… |
| K/(mol·L—1)—2 |
4.1×106 |
K1 |
K2 |
…… |
请完成下列问题:
①试比较K1、K2的大小,K1K2(填写“>”“=”或“<”)
②恒温固定体积的容器中,下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母)。
A.容器内各物质的浓度之比为化学计量数比
B.混合气体密度保持不变
C.容器内压强保持不变
D.混合气体相对分子质量保持不变
(3)某化学小组同学模拟工业生产制取HNO3,设计下图所示装置,其中a为一个可持续鼓入空气的橡皮球。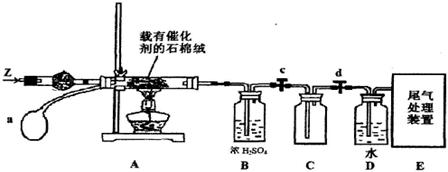
①A中发生反应的化学方程式是。
②B中浓H2SO4的作用是。
(4)写出D装置中反应的化学方程式。
(5)a中通入空气的作用。
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下:
生成氢氧化物沉淀的pH
| Mg(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
| 开始沉淀时 |
9.4 |
6.3 |
1.5 |
| 完全沉淀时 |
12.4 |
8.3 |
2.8 |
(1)MgCO3与稀硫酸反应的离子方程式为。
(2)加氨水调节溶液的PH范围为。
(3)滤渣2 的成分是(填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C MgO+S↓+3CO↑
MgO+S↓+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。
①D中收集的气体是(填化学式)。
②B中盛放的溶液是(填字母)。
a.NaOH 溶液 b.Na2CO3溶液 c.稀硫酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:。