某有机物A经分析,含碳的质量分数为90%,含氢的质量分数为10% 。其蒸气相对于氢气的密度为60,则:
(1)有机物A的分子式为:
(2)经红外光谱测知A为苯的同系物,且核磁共振氢谱峰面积比为3:2:2:2:3,则其结构简式为:
(3)有机物A在一定条件下有下列转化关系:
请回答:
①D中含氧官能团名称:
②B→F的反应类型: ,高分子化合物H的结构简式:
③E→G的化学方程式:
(共12分)I.按要求在下列空格中填出下列有机物的有关式子:
相对分子质量最小的有机物电子式,食醋中的有机物结构式,糖尿病患者尿液中含的糖类结构简式。
II.铍和铝、锂和镁等在元素周期表中具有特殊的“对角线关系”,单质及化合物的性质十分相似。请按要求回答下列各问:
(1)写出Be与NaOH溶液反应的离子方程式(生成Na2BeO2):;(2)Be(OH)2与Mg(OH)2可用试剂鉴别,其离子方程式为:;
Q、R、X、Y为前20号元素中的三种,Y22+、Q的低价氧化物都与X单质分子均为等电子体,R与Q同族。
⑴Q的最高价氧化物,其固体属于晶体,比较Q、X、Y 第一电离能由大到小的顺序。
⑵ R的氢化物属于分子(填“极性”或“非极性”)。
⑶X的常见氢化物的VSEPR模型是;
⑷已知Ti3+可 形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种配合物晶体的样品配成待测溶液;b.分别往待测
形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种配合物晶体的样品配成待测溶液;b.分别往待测 溶液中滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。则绿色晶体配合物的化学式为。
溶液中滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。则绿色晶体配合物的化学式为。
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
| 元素 |
Mn |
Fe |
|
| 电离能 /kJ·mol-1 |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
回答下列问题:
⑴亚铁离子价电子层的电子排布式为
⑵ Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。
①  与Fe原子或离子形成配合物的分子或离子应具备的结构特征是;
与Fe原子或离子形成配合物的分子或离子应具备的结构特征是;
② 六氰合亚铁离子(Fe(CN)64-)中的配体CN-中C原子的杂化轨道类型是,写出一种与CN-互为等电子体的单质分子的电子式;
⑶ 金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为。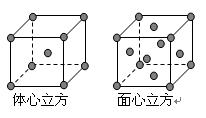
A、B、C、D、E、F、G是元素周期表前四周期的元素,它们在元素周期中的位置如下图所示: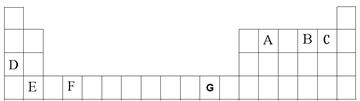
⑴写出G的基态原子核外电子排布式:__________________。
⑵B元素氢化物接近沸点的蒸气的相对分子质量测定值比用化学式计算 出来的相对分子质量大一些,其原因是:。
出来的相对分子质量大一些,其原因是:。
⑶EB晶胞如右图所示,EB晶体中E2+的配位数为 ,EB晶体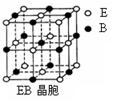
和NaCl晶体中离子排列方式相同,其晶格能分别为:
EB-3401kJ/mol、NaCl-786kJ/mol。导致两者晶格能差异的主要
原因是_______________________________________________。
⑷请用原子结构的知识解释检验D元素时焰色反应产生的现象的原因是
某待测液中(所含阳离子为Na+) 可能含有SO42-、SO32-、Cl-、Br-、
|
NO3-、CO32-、HCO3-中的一种或几种,进行下列实验(每次实验所加试剂均足量)。回答以下问题:
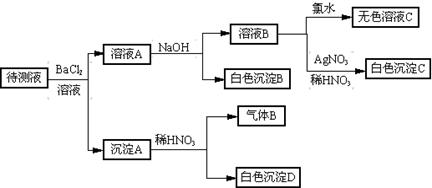
 。
。