铁是日常生活中用途最广、用量最大的金属材料。
(1)常温下,可用铁质容器盛装浓硫酸的原因是 。
(2)某实验小组利用右图装置验证铁与水蒸气的反应。
①湿棉花的作用是 ,试管中反应的化学方程式是 。
②实验结束后,取出少量反应后的固体于试管中,加入过量盐酸,固体完全溶解,所得溶液中存在的阳离子是_____(填序号)。
a.一定有Fe2+、H+和Fe3+ b.一定有Fe2+、H+,可能有Fe3+
c.一定有Fe2+、Fe3+,可能有 H+ d.一定有Fe3+、H+,可能有Fe2+
(3)另称取一定量的铁钉放入适量的浓硫酸中,加热,充分反应后收集气体。经测定气体中含有SO2、CO2和H2。
① 铁与浓硫酸反应的化学方程式是 。
② 气体中混有CO2的原因是(用化学方程式表示) 。
③ 将672 mL(标准状况)收集到的气体通入足量溴水中,发生反应:
SO2 + Br2 + 2H2O =" 2HBr" + H2SO4,然后加入足量BaCl2溶液,经洗涤、干燥得到固体4.66 g。由此推知收集到的气体中SO2的体积分数是 。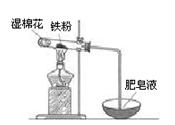
甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料。以CH4和H2O为原料制备甲醇和二甲醚的工业流程如下:
根据要求回答下列问题:
(1)“反应室1”在一定条件下反应的化学方程式为。
(2)水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g)ΔH = -90.8kJ·mol-1
CH3OH(g)ΔH = -90.8kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g)ΔH = -23.5kJ·mol-1
CH3OCH3(g)+H2O(g)ΔH = -23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g)ΔH = -41.3kJ·mol-1
CO2(g)+H2(g)ΔH = -41.3kJ·mol-1
完成热化学反应方程式:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g);ΔH =。
CH3OCH3(g)+CO2(g);ΔH =。
(3)某科研机构研制的一种新型的质子交换膜二甲醚燃料电池(DDFC),该电池有较高的安全性。该电池总反应为CH3OCH3+3O2=2CO2+3H2O,其工作原理如图所示。
电极a的电极反应式为。
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问题
(1)生活中明矾常作净水剂,其净水的原理是(用离子方程式表示)。
(2)常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合,测得混合溶液后的pH=5。写出MOH的电离方程式:。
(3)0.1mol/L的NaHA溶液中,已知有关粒子浓度由大到小的顺序为:
c(Na+)>c(HA—)>c(H2A)>c(A2-)
①该溶液中c(H+)c(OH-)(填“>”、“<”或“=”)。
②作出上述判断的依据是(用文字解释)。
(4)含Cr2O 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:
①绿矾化学式为FeSO4·7H2O。反应(I)的离子方程式为。
②若处理后的废水中c(Cr3+)=3.0×10-6 mol·L-1,则废水中c(Fe3+)=" _________" mol·L-1。(Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH) 3]=6.0×10-31)
T ℃时,在容积为0.5 L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示。已知:物质A、B、C均为气态、D为固态,正反应是吸热反应。根据要求回答下列问题:
(1)容器中反应的化学方程式为。
(2)前2 min,v(A)=______________ mol·(min·L)-1。
(3)能说明该反应已达到平衡状态的是___________。
A.混合气体的压强不变
B.混合气体的密度不变
C.消耗0.1mol的B同时生成0.1mol的D
D.B的物质的量不变
(4)T ℃时,该反应的平衡常数K=_________________(保留小数点后两位)。
(5)反应达到平衡后,改变下列措施能使A的转化率增大的是________(填选项字母)。
A.只增加A的物质的量B.移走一部分D
C.升高反应体系的温度 D.把容器的体积缩小一倍
(6)T ℃时,容积为1 L的密闭容器中,起始时充入0.2 mol A、0.4 mol B、0.3 mol C、0.5 mol D,此时v(正)v(逆)(填“>”“<”或“=”)。
取20mL硫酸和盐酸的混合液体,加入过量的氯化钡溶液,产生4.66g白色沉淀,然后继续向溶液中加入ag(足量)铁粉,产生的气体的体积为896mL(标准状况下)。
(1)写出上述过程中发生的离子方程式_______________________________________
________________________________________________________________________。
(2)计算原混合液体中,硫酸物质的量浓度是_________________mol/L,盐酸物质的量浓度是_____________________mol/L(写出计算过程)。
某氧化铝样品中含有氧化铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案。请回答下列问题:
(1)沉淀A的成分是(填化学式),沉淀B的成分是(填化学式);
(2)写出第④步反应的化学方程式;
(3)在操作Ⅰ的名称是,其中玻璃棒的作用是。