在标准状况下,取甲、乙、丙各30.0mL 相同浓度的盐酸,然后分别慢慢加入组成相同的镁铝合金粉末,得下表中有关数据(假设反应前后溶液体积不发生变化):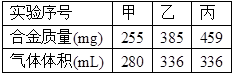
请回答:
(1)甲组实验中,盐酸(选填“过量”、“适量”或“不足量”,下同)__________________;乙组实验中盐酸______________。
(2)盐酸的物质的量浓度为_____________。
(3)合金中Mg. Al 的物质的量之比为_______________。
下图为一个原电池,完成下列问题:
(1)负极材料________,正极材料________,电解质溶液是________。
(2)写出电极反应式:负极:__________________________;
正极:___________________________。
下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
| 主族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 二 |
① |
② |
||||||
| 三 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 四 |
⑨ |
⑩ |
(1)在③~⑦元素中,原子半径最大的是,其离子的结构示意图为;
(2)在③~⑦元素中,元素的最高价氧化物对应的水化物中酸性最强的是,碱性最强的是,呈两性的氢氧化物是;
(3)按要求写出下列两种物质的化学式:①的氢化物;
⑨的最高价氧化物的对应的水化物;
(4)在⑦与⑩的单质中,化学性质较活泼的是,可用什么化学反应说明该事实(写出反应的化学方程式):。
(1)完成下列物质的电子式
| A.Na+, | B.Cl-, | C.H2O, | D.Na2O2 , |
(2)用电子式表示下列化合物的形成过程
H2O; MgCl2。
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。M与X同主族,与W同周期。
(1)M元素是________(填元素符号)。
(2)Z、W形成的气态氢化物的稳定性为>(填化学式)。
(3)M2Z2的电子式为________________,写出M2Z2与水反应的离子方程式:_________________。
(4)由X、Y、Z、W四种元素中的三种组成的—种强酸,该强酸的稀溶液能与铜反应,离子方程式为_________________________。
(5)由X、Y、Z、W四种元素组成的一种离子化合物A,已知:
①1 mol A能与足量NaOH浓溶液反应生成标准状况下44.8 L气体;
②A能与盐酸反应产生气体B,该气体能与氯水反应。
则A是____________(填化学式);写出该气体B与氯水反应的离子方程式 ________________________。
有X、Y、Z、M 、N按原子序数依次递增的五种短周期元素,其中Z、M、N同周期,X、 Z同主族且X是原子半径最小的原子;Y、N同主族,Z+与Y2—具有相同的电子层结构;M的单质晶体熔点高、硬度大,是一种重要的半导体材料。
(1)M的元素名称,N在元素周期表中的位置。
(2)离子半径比较:r(Z+)r(Y2—)。(填“>”、“=”或“<”)
(3)X与Z形成的化合物A是(填“离子化合物”或“共价化合物”),A与X2Y反应的化学方程式是。