(1)请结合必要的方程式,尝试从微粒的电荷情况和电离平衡的移动两方面解释为什么碳酸的分步电离一步比一步困难?(请用方程式并结合必要的文字来回答该小题)
(2)某温度(t℃)时,测得0.01 mol·L-1 NaOH溶液的pH=13,请回答下列问题:
①该温度下水的Kw= 。
②此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液VbL混合(忽略体积变化),若所得混合液为中性,且a=12,b=2,则Va︰Vb= 。
(3)常温下,H2SO3的电离常数Ka1=1.2×10-2,Ka2=6.3×10-8;
H2CO3的电离常数Ka1=4.5×10-7,Ka2=4.7×10-11。某同学设计实验验证H2SO3酸性强于H2CO3:将SO2和CO2气体分别通入水中至饱和,立即用酸度计测两溶液的pH,若前者的pH小于后者,则H2SO3酸性强于H2CO3。该实验设计不正确,错误在于 _____ _____。
请设计合理实验验证H2SO3酸性强于H2CO3(简要说明实验步骤、现象和结论),要求仪器自选。
【供选择的试剂:CO2、SO2、Na2CO3、NaHCO3、Na2SO3、NaHSO3、蒸馏水、饱和石灰水、酸性KMnO4溶液、品红溶液、pH试纸。】______ 。
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。 (1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
(1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。 (2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是
_______________。欲除去Cu2+,最好选用下列试剂中的 (填代号)。 a.NaOH b.Zn c.Fe d.NH3·H2O
a.NaOH b.Zn c.Fe d.NH3·H2O (3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是:
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是: 。若电解电路中通过2mol电子,MnO2的理论产量为 。
。若电解电路中通过2mol电子,MnO2的理论产量为 。
有一化学反应aA+bB=C,根据影响化学反应速率的因素可得vC=k{c(A)}m{c(B)}n。其中k是与温度有关的常数,为测k、m、n的值,在298 K时,将A、B溶液按不同的浓度混合,得到下列实验数据:
(1)根据上表可求得:m=_______,n=______,k=________,k的单位是_______。
(2)用B表示的初始反应速率为___________________。
现将0.40 mol A气体和0.20 mol B气体充入10 L的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量的变化如图: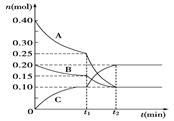
(1)若t1=10 min,则0至t1时间内C物质的平均反应速率为____________;该反应在t2时达到平衡,其化学方程式为__________________________。
(2)据图中曲线变化情况分析,t1时刻改变的反应条件可能是_____ ___。
| A.加入了催化剂 | B.降低了反应温度 |
| C.向容器中充入了C | D.缩小了容器体积 |
(6分)通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能. 已知部分化学键的键能如下:
| 化学键 |
N—H |
N—N |
O==O |
N≡N |
O—H |
| 键能(kJ/mol) |
386 |
167 |
498 |
946 |
460 |
(1)发射神舟飞船的长征火箭用了肼(N2H4,气态)为燃料,若它在氧气(气态)中燃烧,生成N2(气态)和H2O(液态).1 mol肼完全燃烧时放出的热量为________.
(2)为了提高肼(N2H4)燃烧过程中释放的能量,常用二氧化氮作氧化剂代替氧气,这两者反应生成氮气和水蒸气.且:
①N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ/mol
②N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ/mol
试写出肼和NO2完全反应的热化学方程式:____________________________________
(3)随着中国空间技术的发展,中俄于2009年携手探火星工程,寻找更高效的火箭推进剂也被提到了议事日程.在实验室我国科研人员应用电子计算机模拟出具有高能量的物质N60,它的结构与C60十分相似.已知N60分子中每个N原子均以氮氮键结合三个氮原子,且N60分子结构中每个氮原子均形成8个电子的稳定结构.试推测1个N60的结构含有________个N—N键.
A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子分别位于IA , IIIA , VIA族且同周期,B对应碱呈两性,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A ,B,C,D,E
(2)写A与E两元素可形成化合物的电子式:。
(3)写出A、B两元素的最高价氧化物的水化物之间的相互反应的化学方程式:
。
(4) 比较C、D的最高价氧化物的水化物的酸性的强弱:。(用化学式表示)