Ⅰ.请回答:
(1)的电子式
(2)镁燃烧不能用灭火,用化学方程式表示其理由
(3)在沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式
(4)完成以下氧化还原反应的离子方程式:
(___)+(___)+____=(___)+(___)↑+
Ⅱ.化合物甲和都是重要的还原剂。一定条件下金属钠和反应生成甲。甲与水反应可产生,甲与反应可得到。将4.80g甲加热至完全分解,得到金属钠和2.24 L(已折算成标准状况)的。
请推测并回答:
(1)甲的化学式
(2)甲与反应得到的化学方程式
(3)与水发生氧化还原反应的化学方程式
(4)甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为),脱锈过程发生反应的化学方程式
(5)某同学认为:用惰性气体赶尽反应体系中的空气,将铁和盐酸反应后的气体经浓硫酸干燥,再与金属钠反应,得到固体物质即为纯净的甲;取该固体物质与水反应,若能产生,即可证明得到的甲一定是纯净的。
判断该同学设想的制备和验纯方法的合理性并说明理由
有机物A有如下转化关系,在A的质谱图中质荷比最大值为88,其分子中C、H、O三种元素的质量比为6:1:4,且A不能使Br2的CCl4溶液褪色;1mol B反应生成了2mol C。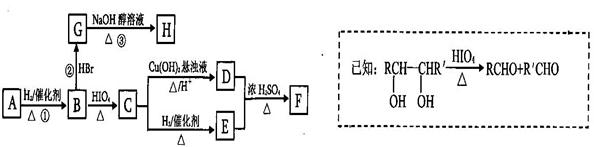
请回答下列问题:
(1)C→E的反应类型为_______________________。
(2)若①、②、③三步反应的产率分别为93.0%、81.0%、88.09%,则由A合成H的总产率为___________________ 。
(3)A的结构简式为__________________________ 。
(4)写出C与银氨溶液反应的离子方程式为________________________________ 。
(5)H分子中所有碳原子均在一条直线上,G转化为H的化学方程式为: ____________________。
(6)X是A的一种同分异构体,且其核磁共振氢谱有3个峰,峰面积之比为1:1:2,1mol X可在HIO4加热的条件下反应,产物只有1mol Y,则X的结构简式为_________________________。
某同学取一定量的Al、Fe混合物,与2.0L极稀的HNO3充分反应,假设HNO3的还原产物全部为铵盐。在反应后的溶液中,逐滴加入4mol·L-1的NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图所示。分析图像回答问题:
(1)DE段发生反应的离子方程式为:_____________________________________ 。
(2)请写出任意一个Al、Fe与极稀HNO3反应的化学方程式:_______________ 。
(3)B点对应的沉淀的物质的量为_______mol,C点对应的氢氧化钠溶液的体积为______mL。
(4)原硝酸溶液的物质的量浓度为_______mol/L。
A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
| 阳离子 |
Na+、Al3+、Ba2+、NH4+ |
| 阴离子 |
Cl-、OH-、CO32-、SO42- |
分别取四种物质进行实验,实验结果如下:
①A、D溶液呈碱性,B呈酸性,C呈中性
②A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失
③A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试纸变蓝
回答下列问题:
(1)A的化学式是_________,用电子式表示C的形成过程:________________ 。
(2)向A溶液中通入适量CO2,使生成的沉淀恰好溶解,所得溶液中各离子物质的量浓度由大到小的顺序是:________________________ 。
(3)写出③的离子方程式_______________________________________________ 。
(4)简述D溶液呈碱性的理由___________________________________________ 。
将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图。(横坐标体积单位是mL,纵坐标质量单位是 g)求:
(1)加入NaOH溶液0--20mL过程中反应方程式
为:_______________________。160--180mL过程中反应方程式为_______________________。
(2)合金中Mg的质量为____________g。所用HCl 的物质的量浓度为____________mol/L。
实验室中需要220mL0.5mol/L H2SO4,现用98%浓硫酸(密度为1.84g/cm3)稀释配制。
(1)本实验室中需要的仪器是。
(2)要将浓硫酸在中稀释,稀释时的操作方法是。
(3)必须将稀释后的硫酸后再移液,原因是,否则,所配制的稀硫酸浓度会(偏高、偏低、无影响)。