Na2S2O3·5H2O(俗称海波或大苏打)是照相业常用的一种定影剂。
(一)常用下列途径制备海波:

已知反应:4FeS+7O2  2Fe2O3+4SO2、Na2SO3+S
2Fe2O3+4SO2、Na2SO3+S Na2S2O3
Na2S2O3
(1)计算原料FeS在反应(a)和(b)中的理论分配比:_________。
(2)现有88gFeS,设NaOH溶液吸收SO2的吸收率为96%,问最多制备海波质量为____克(精确到0.1克)
(二)工业上制得的海波晶体中可能含有少量的亚硫酸钠和硫酸钠杂质。为了测定某海波样品的成分,称取三份质量不同的该样品,分别加入相同浓度的硫酸溶液30mL,充分反应后过滤出硫,微热滤液使生成的SO2全部逸出(Na2S2O3+ H2SO4® Na2SO4+ SO2↑+ S↓+ H2O)。测得有关实验数据如下(标准状况):
| |
第一份 |
第二份 |
第三份 |
| 样品的质量/g |
7.54 |
15.08 |
35.00 |
| 二氧化硫的体积/L |
0.672 |
1.344 |
2.688 |
| 硫的质量/g |
0.80 |
1.60 |
3.20 |
(3)计算所用硫酸溶液的物质的量浓度。(写出计算过程)
(4)分析以上实验数据,可判断该样品__________(填字母)
A.不含Na2SO3和Na2SO4 B.不含Na2SO3 含Na2SO4
C.含Na2SO3不含Na2SO4 D.含Na2SO3和Na2SO4
(5)若将30.16g该样品和一定量的上述硫酸溶液混合微热。试讨论:当加入硫酸的体积______(aL)在不同取值范围时,生成SO2体积___________(bL,标态)的值。(可用含a和b的代数式表示)
实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)、 配制250mL0.1mol/L的盐酸溶液
| 应称量盐酸体积/mL |
应选用容量瓶的规格/mL |
除容量瓶外还需的其它仪器 |
(2)、配制时,其正确的操作顺序是(字母表示,每个字母只能用一次);
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)、操作A中,将洗涤液都移入容量瓶,其目的是,溶液注入容量瓶前需恢复到室温,这是因为_____________________;
(4)、若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响” )
若没有进行A操作;若加蒸馏水时不慎超过了刻度;
若定容时俯视刻度线 _______________。
(5)、若实验过程中出现如下情况如何处理?
加蒸馏水时不慎超过了刻度;
向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面。
某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等离子,进行如下实验:
(1)加入过量的稀盐酸,有白色沉淀产生;(2)过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成;(3)过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现;(4)另取少量步骤(3)中的滤液,加入NaOH溶液至溶液显碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:待测液中一定含有离子,一定不含有 离子,还有一种离子不能确定是否存在,要检验这种离子的实验方法是(只填写实验名称和观察到的现象)
乙醇在浓硫酸的作用下,加热到170℃时生成乙烯。某实验小组同学根据此反应设计了右图装置制取乙烯。请回答: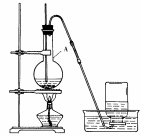
(1)仪器A的名称是。
(2)收集乙烯的方法是。
(3)加热前烧瓶中应加入碎瓷片,其目的是。
(4)该反应的化学方程式为 ,反应类型是(填序号)。a.加成反应 b.消去反应
(5)将生成的乙烯通入高锰酸钾酸性溶液中,观察到的现象是(填序号)。
a.溶液紫色褪去 b.没有明显现象
过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用.它与二氧化碳反应的化学方程式为: 2Na2O2 + 2CO2 ="=" 2Na2CO3 + O2。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95g过氧化钠样品为原料,制取O2,设计出如下实验装置:
(1)A中制取CO2 的装置,应从下列图①、②、③中选哪个图: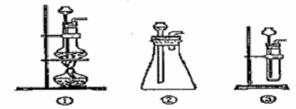
B装置的作用是,C装置内可能出现的现象是。为了检验E中收集到的气体,在取出集气瓶后,用的木条伸入集气瓶内,木条会出现。
(2)若E中的石灰水出现出现轻微白色浑浊,请说明原因:。
(3)若D中的1.95g过氧化钠样品接近反应完毕时,你预测E装置内有何现象?
。
(4)反应完毕时,若测得E中的集气瓶收集到的气体为250mL,又知氧气的密度为1.43g/L,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值(答大或小),这是由于:____________________________________________。
(5)你认为上述A-E的实验装置中,E部分是否安全、合理E是否需要改为下列四项中的哪一项:。(用甲、乙、丙、丁回答)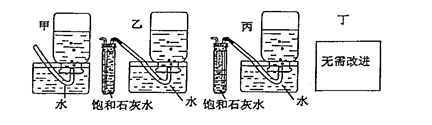
(6分)如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题:
(1)图中的两处明显错误是、。
(2)A仪器的名称是。B仪器的名称是。
(3)实验时A中除加入少量水以外,还需加入少量。其作用是。
。