舒林酸(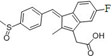 )广泛适用于各种关节炎以及各种原因引起的疼痛的临床治疗。它的一种合成路线如下:
)广泛适用于各种关节炎以及各种原因引起的疼痛的临床治疗。它的一种合成路线如下: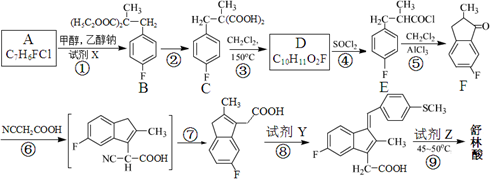
(1)反应条件:①对氟甲苯制备A:_______________;②反应②(彻底):______________________。
(2)有机物D的分子量最小的同系物的结构简式为_____________。(任写一种)
(3)反应类型:⑥__________、______________ ;⑨______________。
(4)符合下列条件的有机物F的同分异构体有__________种。
①能与氯化铁溶液发生显色反应;
②苯环上只有2种不同化学环境的氢原子;
③苯环上有2个侧链;
④与Br2发生1:1加成时,可得到3种加成产物。
(5)反应⑧的产物还有水,则试剂Y的结构简式为______________。
(6)利用舒林酸合成中的信息,写出实验室由以CH2(COOC2H5)2、1,4-二溴丁烷为原料(无机试剂、三碳以下的有机试剂等试剂任选)制备  的合成路线。
的合成路线。
(合成路线常用的表示方式为: )
)
有A、B、C、D四种化合物,分别由K+、Ba2+、SO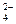 、CO
、CO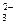 、OH-中的两种组成,它们具有下列性质:①A不溶于水和盐酸;②B不溶于水,但溶于盐酸,并放出无色无刺激性气味的气体E;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。请回答:
、OH-中的两种组成,它们具有下列性质:①A不溶于水和盐酸;②B不溶于水,但溶于盐酸,并放出无色无刺激性气味的气体E;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。请回答:
(1)写出化学式:A; C;D;
(2)写出下列反应的离子方程式。
B与盐酸反应 _______________________
E与过量的澄清石灰水反应 ___________________________
(1)用“双线桥法”表示出下列反应中电子得失、化合价升降与氧化还原的关系:
2Fe2O3+3C 4Fe+3CO2↑
4Fe+3CO2↑
(2)用“单线桥法”表示出下列反应中电子转移的方向和数目,并指出氧化剂和还原剂。
C+2H2O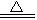 2H2+CO2
2H2+CO2
现有下列十种物质:①H2 ②铝 ③Na2O ④CO2⑤H2SO4 ⑥Ba(OH)2⑦红褐色的氢氧化铁胶体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)其中,属于混合物的是 ,属于氧化物的是,属于单质的是。(本小题均用序号作答)
,属于氧化物的是,属于单质的是。(本小题均用序号作答)
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH- H2O,该离子反应对应的化学方程式为。
H2O,该离子反应对应的化学方程式为。
(3)17.1g⑩ 溶于水配成250mL溶液, SO42-的物质的量浓度为。
(8分)按照下表左边的实验操作,可以观察到表中右边的实验现象。请从“实验现象”栏中选择正确选项的字母代号填入对应的空格中。
| 实验操作 |
答案 |
实验现象 |
||||
| (1) 将KSCN溶液滴入FeCl3溶液中 |
|
|||||
| (2) 将C2H4通入酸性KMnO4溶液中 |
||||||
| (3) 将浓HNO3滴入蛋白质溶液中,微热 |
||||||
| (4) 将葡萄糖溶液滴入到新制的Cu(OH)2中,加热 |
甲、乙、丙、丁四种单质在点燃条件下两两化合生成X、Y、Z、W四种化合物,转化关系如图所示,又知:
①甲、乙、丙均为前三周期元素的单质,常温下均为气态,
丁是日常生活中的一种常见金属;
②常温下,X是无色液体,Y是黑色固体;
③丙在乙中燃烧发出苍白色的火焰,丁在乙中燃烧生成棕黄色
的烟,W的水溶液呈黄色。
回答下列问题:
(1) 写出下列物质的化学式: X W
(2)将乙单质通入紫色石蕊试液中,看到的现象是 。
(3)写出丁单质与Z的水溶液反应的化学方程式 。