甲、乙、丙、丁四种单质在点燃条件下两两化合生成X、Y、Z、W四种化合物,转化关系如图所示,又知:
①甲、乙、丙均为前三周期元素的单质,常温下均为气态,
丁是日常生活中的一种常见金属;
②常温下,X是无色液体,Y是黑色固体;
③丙在乙中燃烧发出苍白色的火焰,丁在乙中燃烧生成棕黄色
的烟,W的水溶液呈黄色。
回答下列问题:
(1) 写出下列物质的化学式: X W
(2)将乙单质通入紫色石蕊试液中,看到的现象是 。
(3)写出丁单质与Z的水溶液反应的化学方程式 。
下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。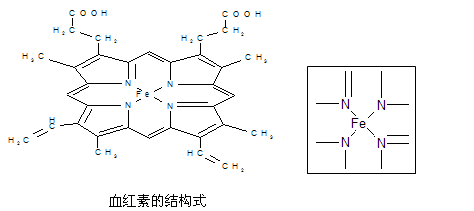
回答下列问题:
⑴血红素中含有C、H、O、N、Fe五种元素,C、N、O三种元素的第一电离能由小到大的顺序是,写出基态Fe原子的核外电子排布式。
⑵血红素中N原子的杂化方式为,在右上方的方框内用“→”标出Fe2+的配位键。
⑶铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为,δ、α两种晶胞中铁原子的配位数之比为。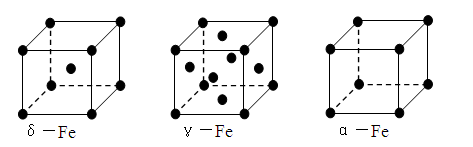
已知:① CH3CH=CHCH2CH3 CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
② R-CH=CH2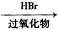 R-CH2-CH2-Br
R-CH2-CH2-Br
香豆素的核心结构是芳香内酯A,A经下列步骤转变为水杨酸。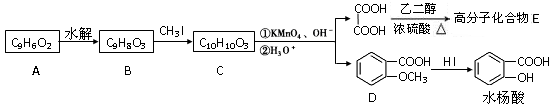
请回答下列问题:
(1)下列有关A、B、C的叙述中不正确的是
a.C中核磁共振氢谱共有8种峰 b.A、B、C均可发生加聚反应
c.1mol A最多能和5mol氢气发生加成反应 d.B能与浓溴水发生取代反应
(2)B分子中有2个含氧官能团,分别为和(填官能团名称),B→C的反应类型为。
(3)在上述转化过程中,反应步骤B→C的目的是。
(4)化合物D有多种同分异构体,其中一类同分异构体是苯的对二取代物,且水解后生成的产物之一能发生银镜反应。请写出其中一种的结构简式:。
(5)写出合成高分子化合物E的化学反应方程式:。
(6)写出以 为原料制备
为原料制备 的合成路线流程图(无机试剂任用),并注明反应条件。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用),并注明反应条件。合成路线流程图示例如下: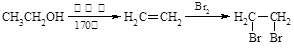
随着工业的迅速发展,产生的废水对水体的污染也日趋严重。通过控制溶液的pH对工业废水中的金属离子进行分离是实际工作中经常使用的方法。下表是常温下金属氢氧化物的Ksp(沉淀溶解平衡常数)和金属离子在某浓度下开始沉淀所需的pH(表中浓度为相应pH时溶液中有关金属离子产生沉淀的最小浓度;当溶液中金属离子浓度小于10-5 mol•L-1时通常认为该离子沉淀完全)。
| 金属离子 |
Ksp |
pH(10-1 mol•L-1) |
pH(10-5 mol•L-1) |
| Fe3+ |
4.0×10-38 |
2.7 |
3.7 |
| Cr3+ |
6.0×10-31 |
4.3 |
5.6 |
| Cu2+ |
2.2×10-20 |
4.7 |
6.7 |
| Ca2+ |
4.0×10-5 |
12.3 |
14.3 |
(1)某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1 mol•L-1。为除去其中的Fe3+,回收铜,需控制的pH范围是_______________________________。
(2)为了处理含有Cr2O72-酸性溶液的工业废水,采用如下方法:向废水中加人适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。
①Cr2O72-转变为Cr3+的离子方程式为______________________。
②pH对废水中Cr2O72-去除率的影响如图。你认为电解过程中溶液的pH取值在______范围内对降低废水中的铬含量最有利,请说明理由:_________________________________。
[注:去除率(%)=[(c0-c)/co]×100%,式中:co—处理前废水中Cr2O72-浓度,c—处理后废水中Cr2O72-的浓度]
(3)沉淀转化在生产中也有重要应用。例如,用Na2CO3溶液可以将锅炉水垢中的CaSO4转化为较疏松而易清除的CaCO3,该沉淀转化达到平衡时,其平衡常数K=_________(写数值)。[已知Ksp (CaSO4)=9.1x10-6,Ksp (CaCO3)=2.8×10-9]
(1)已知:①N2(g)+O2(g)=2NO(g); △H=+180.5 kJ·mol-1
②4NH3(g)+5O2(g)= 4NO(g)+6H2O(g);△H="-905" kJ·mol-1
③2H2(g)十O2(g)=2H2O(g):△H=-483.6 kJ·mol-1
则N2(g)+3H2(g)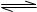 2NH3(g)的△H=。
2NH3(g)的△H=。
(2)在一定条件下,将2mol N2与5mol H2混合于一个10 L的密闭容器中,反应情况如图1所示:
①求5min内的平均反应速率v(NH3)=;②达到平衡时NH3的体积分数为。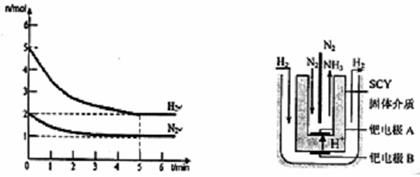
图1图2 电解法合成氨装置
(3)近年来科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A上发生的电极反应式是。
(4)草酸(H2C2O4)是一种重要的化工原料。已知常温下0.01 mol·L-l的H2C2O4、KHC2O4、K2C2O4 溶液的pH如下表所示。
| H2C2O4 |
KHC2O4 |
K2C2O4 |
|
| pH |
2.0 |
3.1 |
8.1 |
①用离子方程式表示KHC2O4呈酸性的原因:
②取一定质量H2C2O4·2H2O和KHC2O4的混合物,加水溶解,配成250 mL溶液,取两份此溶液各25 mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25 mol·L-l NaOH溶液至20.00 mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3 mol·L-l H2SO4溶液酸化后,用0.10 mol·L-l KMnO4溶液滴定,当消耗KMnO4溶液16.00 mL时,溶液由无色变为浅紫红色。请回答下列问题:
a.完成离子方程式:C2O42-+MnO4-+H+=CO2+Mn2++H2O。
b. 原混合物中H2C2O4·2H2O和KHC2O4的物质的量之比为__________。
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为
2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为
(2)酸溶及后续过程中均需保持盐酸过量,其目的是、。
(3)通氯气氧化时,发生的主要反应的离子方程式为
该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为(写化学式)。