已知碳碳双键可以被臭氧氧化:
有机物A可以发生如下图所示的变化,其中E不能发生银镜反应,M的分子内含有七元环状结构。
(1)A的结构简式为________。
(2)A~M中,互为同系物的是________(填字母代号)。
(3)B的同分异构体中,具有链状结构的酯类物质有________种,请写出其中一种物质的结构简式:________。
(4)写出下列反应的化学方程式。
①F―→G:______________________。
②C+L―→M:______________________。
(12分)舍勒发现氯气的的方法至今还是实验室制取氯气的主要方法之一.
(1)请写出实验室制氯气的反应化学方程,
(2)反应方程式中氧化剂和还原剂物质的量之比为;其中Cl2是产物(填氧化或还原);
(3)如右图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是 ,从而得出的结论是.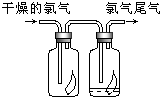
(4)实验室中剩余的Cl2尾气通常用NaOH溶液吸收,发生反应的离子方程式。
已知:I2+2S2O===S4O+2I-。相关物质的溶度积常数见下表:
| 物质 |
Cu(OH)2 |
Fe(OH)3 |
CuCl |
CuI |
| Ksp |
2.2×10-20 |
2.6×10-39 |
1.7×10-7 |
1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入,(填化学式)调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是(用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用作滴定指示剂,滴定终点的现象是。
②CuCl2溶液与KI反应的离子方程式为。
③该试样中CuCl2·2H2O的质量百分数为。
如图所示3套实验装置,分别回答下列问题。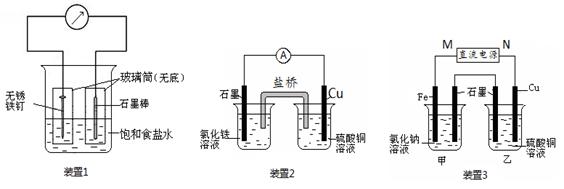
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6] 溶液,即可观察到铁钉附近的溶液有蓝色沉淀,表明铁被(填“ 氧化”或“还原”); 向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为。
(2)装置2中的石墨是极(填“正”或“负”),该装置发生的总反应的离子方程式为。
(3)装置3中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红。
① 电源的M端为极(填“正”或“负”),甲烧杯中铁电极的电极反应为。
② 乙烧杯中电解反应的化学方程式为。
③ 停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 0.64 g,甲烧杯中产生的气体标准状况下体积为mL 。
常温下,将3种一元酸分别和NaOH溶液等体积混合,实验数据如下:
| 组别 |
一元酸 |
NaOH |
混合溶液的pH |
| 甲 |
c(HX)="0.1" mol/L |
c(NaOH)=0.1mol/L |
pH = a |
| 乙 |
c(HY)=c1 mol/L |
c(NaOH)=0.1mol/L |
pH = 7 |
| 丙 |
c(HZ)="0.1" mol/L |
c(NaOH)=0.1mol/L |
pH = 9 |
| 丁 |
pH=2 HZ |
pH=12 NaOH |
pH = b |
(1)甲组实验中HX为弱酸,a7(填“<”,“=”或“>”),
混合溶液中离子浓度由大到小顺序为。
(2)乙组实验中HY为强酸,则HY溶液的pH=。
(3)丙组实验发生反应的离子方程式为,
所得溶液中由水电离出的c (OH-) = mol/L。
(4)丁组实验中b 7(填“<”,“=”或“>”)。
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。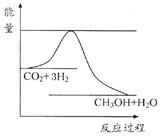
(1)关于该反应的下列说法中,正确的是。(填字母)
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)该反应平衡常数K的表达式为。
(3)温度降低,平衡常数K(填“增大”、“不变”或“减小”)。
(4)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时问变化如下图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)为mol·L-1·min-1。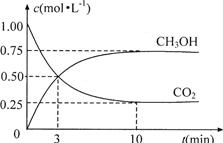
(5)下列措施中能使(4)中n(CH3OH)/n(CO2)增大的有。(填字母)
A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.再充入1molCO2和3molH2
E.充入He(g),使体系总压强增大