化合物M是一种治疗心脏病药物的中间体,以A为原料的工业合成路线如下图所示。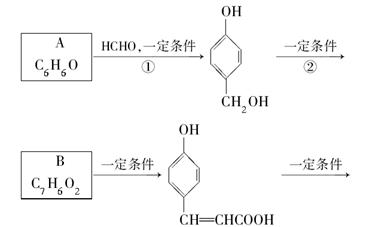
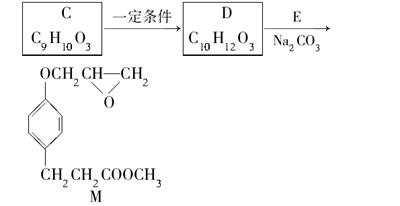
已知:RONa+R′X→ROR′+NaX
根据题意完成下列填空:
(1)写出反应类型。反应①________,反应②________。
(2)写出结构简式 A________,C________。
(3)写出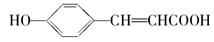 的邻位异构体分子内脱水产物的结构简式________。
的邻位异构体分子内脱水产物的结构简式________。
(4)由C生成D的另一个反应物是________,反应条件是________。
(5)写出由D生成M的化学反应方程式____________________________________。
(6)A也是制备环己醇(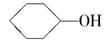 )的原料,写出检验A已完全转化为环己醇的方法________________。
)的原料,写出检验A已完全转化为环己醇的方法________________。
在试管里放入一块铜片,注入一定体积的浓硫酸,给试管加热,使之反应。
(1)若铜片还有剩余,硫酸________消耗完毕(填“已”或 “没有”)。其理由是___________________________________________________________________。
“没有”)。其理由是___________________________________________________________________。
(2)用一定量的废铜屑制取胆矾,有两种方法:一种是取Cu与浓H2SO4直接反应;二是先将铜在空气中加热使之生成CuO,再与稀H2SO4反应,其中_________种方法好,理由是 _____________________________________________________。
A、B、C、D、E分别为(NH4)2SO4、NH4Cl 、NaCl 、Na2SO4、Ba(OH)2五种溶液中的某一种,把它们两两混合:
(1)A和B混合产生白色沉淀,加热,无明显变化;
(2)B和C混合产生白色沉淀,加热,产生使湿润红色石蕊试纸变蓝的气体;
(3)B和E混合无明显变化,加热,产生使湿润红色石蕊试变蓝的气体。
根据以上现象,判断A、B、C、D、E各为什么物质(写物质名称)。
A:、B:、C:、
D:、E:。
氨气极易溶于水,其水溶液显_________(酸性、中性、碱性)。氨气和氯化氢在空气中相遇时,可以看到的现象是__________。
有一瓶无色气体,可能含有CO2,HCl,HBr,SO2 中的一种或几种气体,将气体通入适量氯水中,得到无色透明的溶液,继续向该溶液中加入少量的BaCl2溶液和盐酸,有白色沉淀产生。则原气体中一定含有__________,肯定不含有__________。
如图所示的A、B、C、D、E五种物质的相互转化关系,按如下要求填写相应的物质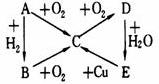
当A是气体单质时,B是______,C是_____,E是______。