油脂是重要的营养物质。某天然油脂A可发生下列反应: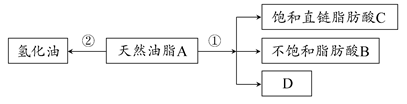
已知:A的分子式为C57H106O6。1 mol该天然油脂A经反应①可得到1 mol D、1 mol不饱和脂肪酸B和2 mol直链饱和脂肪酸C。经测定B的相对分子质量为280,原子个数比为C:H:O=9:16:1。
(1)写出B的分子式:________。
(2)写出反应①的反应类型:________;C的名称(或俗称)是________。
(3)近日,电视媒体关于“氢化油危害堪比杀虫剂”的报道引发轩然大波,反应②为天然油脂的氢化过程。下列有关说法不正确的是________。
a.氢化油又称人造奶油,通常又叫硬化油
b.植物油经过氢化处理后会产生副产品反式脂肪酸甘油酯,摄入过多的氢化油,容易堵塞血管而导致心脑血管疾病
c.氢化油的制备原理是在加热植物油时,加入金属催化剂,通入氢气,使液态油脂变为半固态或固态油脂
d.油脂的氢化与油脂的皂化都属于加成反应
(4)D和足量金属钠反应的化学方程________________________________。
(10分)下图表示的反应关系中,部分产物被略去。已知2mol白色固体粉末X受热分解,恢复到室温生成白色固体A,无色液体B,无色气体C各1mol。X.E.G的焰色反应均为黄色。
回答下列问题:
(1)写出下列物质的化学式:A.
(2)写出X受热的化学反应方程式:
(3)写出X+E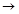 A的离子方程式:
A的离子方程式:
(4)写出C与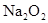 参加反应的化学方程式______________________________________,若0.2mol
参加反应的化学方程式______________________________________,若0.2mol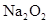 参加反应,则转移的电子数为_____________个。
参加反应,则转移的电子数为_____________个。
(1)①写出Na2SO4的电离方程式。
②氧化铝和氢氧化钠溶液反应的离子反应方程式。
③ OH- + H+ ="=" H2O改写为化学方程式。
(2)粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,除去这些杂质的试剂可选用
①Na2CO3、②NaOH、③BaCl2、④ HCl ,加入的先后顺序可以是。
(3)下列实验操作中不正确的是(多选)。
| A.用分液的方法分离水和汽油的混合物 |
| B.用过滤的方法分离饱和食盐水与沙子的混合物。 |
| C.蒸馏时,应使温度计水银球插入液面以下 |
| D.蒸发结晶时应将溶液蒸干后再停止加热 |
E.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
(16分)I、为减少温室效应,科学家设计反应:CO2+4H2==CH4+2H2O以减小空气中CO2。
(1)若有1mol CH4生成,则有mol σ键和mol π键断裂。
(2)CH4失去H—(氢负离子)形成CH+3(甲基正离子)。已知CH+3的空间结构是平面正三角形,则CH+3中碳原子的杂化方式为。
Ⅱ、金属原子与CO形成的配合物称为金属羰基配合物(如羰基铁)。形成配合物时,每个CO提供一对电子与金属原子形成配位键,且金属原子的价电子和CO提供的电子总和等于18。
(3)金属羰基配合物中,微粒间作用力有(填字母代号)。
a、离子键 b、共价键 c、配位键 d、金属键
(4)羰基铁是一种黄色油状液体,熔点-21℃、沸点102.8℃。由此推测,固体羰基铁更接近于(填晶体类型)。若用Fe(CO)x表示羰基铁的化学式,则x=。
III.研究表明,对于中心离子为Hg2+等阳离子的配合物,若配位体给出电子能力越强,则配位体与中心离子形成的配位键就越强,配合物也就越稳定。
(5)预测HgCl42-与HgI42-的稳定性强弱,并从元素电负性的角度加以解释。
答:HgCl42-比HgI42-更(填“稳定”或“不稳定”),因为。
(16分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F,其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。A、C两元素可形成非极性分子AC2。E、F两元素同周期、同族,且原子序数相差2。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为。
(2)B的氢化物的分子空间构型是。
(3)写出化合物AC2的结构式;一种由B、C组成的化合物与AC2互为等电子体,其化学式为。
(4)E原子的核外电子排布式是,
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是。
(6)若A与B两元素组成的晶体M,已知M具有与A元素形成的晶体相似的空间网状结构,请你判断晶体M与A元素的晶体硬度大小关系是:MA晶体(填>、<、=),并说明理由:________________________________。
将质量分数为98%,密度为1.84 g·cm-3的浓硫酸,用蒸馏水稀释到9.2 mol/L的硫酸,则其质量分数49%(填>、<、=)。