某高分子化合物的部分结构如下: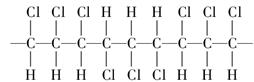
下列说法正确的是( )
A.聚合物的链节是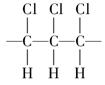 |
| B.聚合物是缩聚反应产物 |
C.聚合物的单体是 |
| D.若n为聚合度,则其相对分子质量为97n |
用CO合成甲醇(CH3OH)的化学反应方程式为CO(g)+2H2(g) CH3OH(g) ΔH < 0。按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
CH3OH(g) ΔH < 0。按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
| A.正反应速率:v(a)>v(c) v(b)>v(d) |
| B.平衡时a点一定有n(CO):n(H2)=1:2 |
| C.平衡常数:K(a)>K(c) K(b)=K(d) |
D.平均摩尔质量: (a)< (a)< (c) (c)  (b)> (b)> (d) (d) |
如图所示,向A中充入1 mol X和1 mol Y,向B中充入2 mol X和2 mol Y,起始VA=VB=a L,在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g) 2N(g)+W(g) ΔH>0,达到平衡时,v(A)=1.2aL,则下列说法错误的是()
2N(g)+W(g) ΔH>0,达到平衡时,v(A)=1.2aL,则下列说法错误的是()
A.反应开始时,B容器中化学反应速率快
B.A容器中X的转化率为40%,且比B中X的转化率小
C.打开K达新平衡后,升高B容器温度,A容器体积会增大
D.打开K一段时间,达到新平衡时,A的体积为2.6aL(两边通管中气体体积不计)
将2 mol A与2 mol B混合于2 L的密闭容器中,发生如下反应:2A(g)+3B(g)  2C(g)+zD(g),若2分钟后达到平衡,A的转化率为50%,测得:v(D)=0.25 mol/(L·min),则下列推断正确的是()
2C(g)+zD(g),若2分钟后达到平衡,A的转化率为50%,测得:v(D)=0.25 mol/(L·min),则下列推断正确的是()
A.v(C)=0.2 mol/(L·min)B.z=3
C.B的转化率为25% D.C的体积分数约为28.6%
常温下,将0.02 mol·L-1的Ba(OH)2溶液100 mL和0.02 mol·L-1的NaHSO4溶液100 mL混合,若忽略溶液体积变化,则混合后的溶液()
| A.由水电离产生的c(H+)=1.0×10-2 mol·L-1 |
| B.pH=12 |
| C.pH=2 |
| D.混合后的溶液溶质的物质的量浓度为0.02 mol·L-1 |
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示。据图判断正确的是()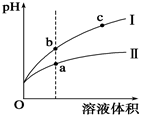
| A.Ⅱ为盐酸稀释时的pH值变化曲线 |
| B.b点酸的总浓度大于a点酸的总浓度 |
| C.a点Kw的数值比c点Kw的数值大 |
| D.b点溶液的导电性比c点溶液的导电性强 |