对四支分别盛有无色溶液的试管,进行如下操作,结论正确的是
| |
操作 |
现象 |
结论 |
| A |
滴加氯水和CCl4,振荡、静置 |
下层溶液显紫红色 |
原溶液中有I- |
| B |
滴加BaCl2溶液 |
生成白色沉淀 |
原溶液中一定有SO42- |
| C |
用铂丝蘸取溶液进行焰色反应 |
火焰呈黄色 |
原溶液中有Na+、无K+ |
| D |
滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 |
试纸不变蓝 |
原溶液中一定无NH4+ |
下列物质中,水解的最终产物不含葡萄糖的是
| A.蔗糖 | B.淀粉 | C.纤维素 | D.油脂 |
下图是某只含有C、H、O、N的有机物简易球棍模型。下列关于该有机物的说法正确的是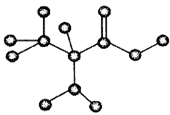
A、分子式为C3H7NO B、在一定条件下,可以生成高分子化合物
C、不能和盐酸溶液反应D、不能和NaOH溶液反应
下列反应中不能引入羟基(—OH)的是
| A.加成反应 | B.取代反应 | C.消去反应 | D.还原反应 |
对于丙烯醛CH2=CHCHO的性质叙述错误的是
| A.能使溴水退色 | B.能与新制Cu(OH)2悬浊液反应 |
| C.与足量的氢气反应生成1-丙醇 | D.不能发生银镜反应 |
下列分子中,所有原子都处在同一平面的是
| A.环已烷 | B.丙烷 | C.乙烷 | D.苯 |