氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂。钙在加热时能与氮气、氢气反应。氢化钙遇水立即反应生成氢氧化钙和氢气。氢化钙通常用氢气与金属钙加热制取,下图是模拟制取装置。
(1)下列关于氢化钙的叙述正确的是 (选填序号)。
a.氢化钙中阴离子的半径小于Li+的半径
b.氢化钙的式量小于溴化氢,因此前者的熔点小于后者
c.氢化钙也能与盐酸反应生成氢气
d.氢气常用作还原剂,只具有还原性
(2)上图A装置中制备氢气所用的酸溶液最好选用 (选填序号)。
a.稀盐酸 b.稀硫酸 c.稀硝酸 d.均可以
(3)装置D中竖直导管的作用是 。
(4)为了确认进入装置C的氢气已经干燥,可在B、C之间再接一装置,该装置中加入的试剂是 。加热C装置前要对H2验纯,验纯的操作是 。
(5)甲同学认为只要装置合理、操作规范就可以排除生成 (选填序号)。
a.Ca3N2 b.CaO c.Ca(OH)2
(6)乙同学用下图装置测定制得的氢化钙的纯度。他称取48g样品,与足量的水反应,恒温时,注射器量出产生的气体为48.16 L(已换算为标准状况)。假设钙只与氢气发生了反应,请根据乙同学的实验数据计算氢化钙的纯度(写出计算过程) 。
氨有着广泛的用途,可用于化肥、硝酸、合成纤维等工业生产。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应可生成氨气:
该反应在固定体积的密闭容器中进行,有关说法正确的是_____________(填序号字母)。
A.反应处于平衡状态时,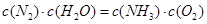 |
B.反应达到平衡后, |
| C.体系的总压强不变,说明反应已达平衡 |
| D.混合气体的密度保持不变,说明反应已达平衡 |
(2)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧试验机中相关的反应有: ①
① ②
② ③
③
请写出上述三个反应中 、
、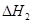 、
、 三者之间关系的表达式,
三者之间关系的表达式, =_________。
=_________。
(3)工业制硝酸的主要反应是:
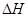 =
=
①升高温度,反应的K值减小,则Q______(填“>”、“<”或“=”)0。
②若反应起始的物质的量相同,下列关系图错误的是________(填序号)。

③在容积固定的密闭容器中发生上述反应,容器内部分物质的浓度如下表:
| 时间/浓度 |
  |
  |
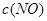  |
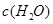  |
| 起始 |
4.0 |
5.5 |
0 |
0 |
| 第2min |
3.2 |
a |
0.8 |
1.2 |
| 第4min |
2.0 |
3.0 |
2.0 |
3.0 |
| 第6min |
2.0 |
3.0 |
2.0 |
3.0 |
反应在第2 min到第4 min时,O2的平均反应速率为________。
反应在第2 min时改变了条件,改变的条件可能是______________________________。
该条件下,反应的平衡常数K=________。
某化学兴趣小组利用废弃铝矿(含CuO、Al2O3及SiO2),模拟工业上提取铝的工艺,设计如下图所示的简单操作流程:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
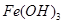 |
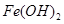 |
 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)滤渣主要成分的化学式为______________________。
(2)灼烧 时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有___________(填仪器名称)。
时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有___________(填仪器名称)。
(3)溶液Y中要加入稍过量原料A,原料A的化学式是_________,步骤⑤反应的离子方程式是_______________________。
(4)操作流程中③的离子方程式为_______________________。
(5)铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如图所示:
请写出该电池正极反应式_________________;常温下,用该化学电源和惰性电极电解300mL氯化钠溶液(过量),消耗27mg Al,则电解后溶液的pH=_________(不考虑溶液体积的变化)。
(6)以熔融盐为电镀液可以在钢材表面镀铝,镀铝电解池中,钢材为________极;镀铝后能防止钢材腐蚀,其原因是____________________________________。
已知:A为淡黄色固体,E、X常温下为气体,A、B、C、D含有相同的金属离子,其转化关系如下图(部分产物已略去)。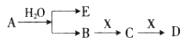
请回答下列问题:
(1)B中所含化学键的类型是______________;
(2)常温常压下,7.8g A与足量的水充分反应放出热量a kJ,写出该反应的热化学方程式____________________。
(3)①C也可转化为B,写出该转化的化学方程式_______________;
②B与D反应的离子方程式为__________________________。
(4)将一定量的气体X通入2L B的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。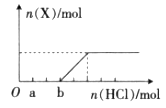
请回答:a点溶液中所含溶质的化学式为__________,b点溶液中各离子浓度由大到小的关系是___________________。
(5)将C溶液与氢氧化钡溶液混合可得不溶物F,F的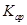 =2.5×
=2.5×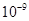 。现将该沉淀放入0.5 mol·
。现将该沉淀放入0.5 mol·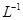 的BaCl2溶液中,其
的BaCl2溶液中,其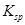 ________(填“增大”、“减小”或“不变”),组成不溶物F的阴离子在溶液中的浓度为________mol·
________(填“增大”、“减小”或“不变”),组成不溶物F的阴离子在溶液中的浓度为________mol·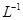 。
。
随着对有机高性能纤维的不断深入研究,美国已开发出一种超高性能纤维,该纤维不仅具有PBO纤维的抗张性能,而且还有优于PBO纤维的抗压缩性能。下面是以对二甲苯为原料合成该纤维的合成路线(有些反应未注条件)。请回答: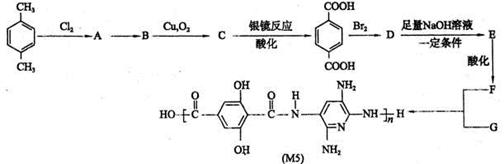
(1)写出合成该纤维的单体F的结构简式:。
(2)反应类型:A→B,B→C。
(3)写出化学方程式(注明反应条件):
B→C; D→E。
(4)若1molF与足量Na2CO3溶液完全反应,则消耗Na2CO3mol
(5)写出两种符合下列条件物质的结构简式:、。
①与B互为同分异构体②遇FeCl3溶液有显色反应
③核磁共振氢谱有3组峰,且峰面积之比为3:1:1。
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是______;
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为______;
(3)Se原子序数为______,其核外M层电子的排布式为______;
(4)H2Se的酸性比H2S__________(填“强”或“弱”)。气态SeO3分子的立体构型为______平面三角形,SO32-离子的立体构型为______三角锥形;
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:;第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子;
②H2SeO4比H2SeO3酸性强的原因:______;
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶胞边长为540.0 pm,密度为____________(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为___________________pm(列式表示)。