铅蓄电池的反应原理为:2PbSO4+2H2O Pb+PbO2+2H2SO4,下列叙述中,正确的是
Pb+PbO2+2H2SO4,下列叙述中,正确的是
| A.PbSO4的氧化性比PbO2的强、还原性比Pb的强 |
| B.放电时,PbO2为氧化剂、做负极,Pb为还原剂、做正极 |
| C.放电时,当有2 mol H2SO4反应时,会有1.204×1024个电子从铅电极流出 |
| D.充电时,PbSO4既被氧化又被还原,Pb是阳极产物之一 |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.常温常压下,4.4 g CO2与N2O混合气体中含有的原子总数为0.3NA |
| B.标准状况下,2.24L己烷含有分子的数目为0.1NA |
| C.1 L 1 mol·L-1的CuCl2溶液中含有Cu2+的数目为NA |
| D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
经一定时间后,可逆反应aA+bB  cC中物质的含量A%和C%随温度的变化曲线如下图所示,下列说法正确的是
cC中物质的含量A%和C%随温度的变化曲线如下图所示,下列说法正确的是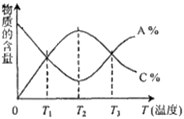
| A.该反应在T1、T3温度时达到化学平衡 |
| B.该反应在T1温度时达到化学平衡 |
| C.该反应为放热反应 |
| D.升高温度,平衡会向正反应方向移动 |
下列装置所示的实验中,能达到实验目的的是
下列说法中正确的是
A.常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(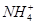 )、c(H+)均下降 )、c(H+)均下降 |
B.常温下,c(N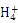 )相等的①(NH4)2SO4②(NH4)2Fe(SO4)2③NH4Cl④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③ )相等的①(NH4)2SO4②(NH4)2Fe(SO4)2③NH4Cl④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③ |
| C.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
D.当溶液中存在的离子只有Cl-、OH-、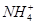 、H+时,该溶液中离子浓度大小关系可能为c(Cl-)>c( 、H+时,该溶液中离子浓度大小关系可能为c(Cl-)>c(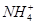 )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
下列物质转化在给定条件下能实现的是
①
②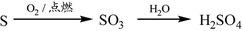
③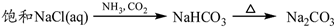
④
⑤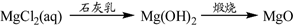
| A.①③⑤ | B.②③④ | C.②④⑤ | D.①④⑤ |