实验:① 将0.1 mol·L-1 MgCl2溶液和0.5 mol·L-1NaOH溶液等体积混合得到浊液;
② 取少量①中浊液,滴加0.1 mol·L-1FeCl3溶液,出现红褐色沉淀;
③ 将①中浊液过滤,取少量白色沉淀,滴加0.1 mol·L-1FeCl3溶液,白色沉淀变为红褐色;
④ 另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解。
下列说法中,不正确的是:
| A.将①中所得浊液过滤,所得滤液中含少量Mg2+ |
B.浊液中存在溶解平衡:Mg(OH)2(s)  Mg2+(aq) + 2OH-(aq) Mg2+(aq) + 2OH-(aq) |
| C.实验②和③均能说明Fe(OH)3比Mg(OH)2难溶 |
| D.NH4Cl溶液中的NH4+可能是④中沉淀溶解的原因 |
下列说法正确的是
| A.用30%的H2O2消除面部色斑 |
| B.当不慎在皮肤上沾上少量的浓H2SO4时,应立即用大量水冲洗,并涂上2%的NaHCO3溶液 |
C.试样 白色沉淀 白色沉淀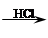 白色沉淀不溶解,则试样中一定有SO42- 白色沉淀不溶解,则试样中一定有SO42- |
| D.不慎将浓盐酸洒在桌上,应立即用浓NaOH溶液冲洗 |
下列说法正确的是
| A.摩尔是七个基本物理量之一 |
| B.测得1 mol某气体的体积为22.4L,则测定条件一定是标准状况 |
| C.配制一定物质的量浓度的NaCl溶液时,定容、振荡、摇匀后,发现液面低于刻度线,再加水到刻度线 |
| D.凡是只能电离出H+,这个电离产生阳离子的化合物都是酸 |
化合物A、B是中学常见的物质,其阴、阳离子只能从下表中选择:
| 阳离子 |
K+、Na+、Fe2+、Ba2+、NH4+、Ca2+ |
| 阴离子 |
OH-、NO3-、I-、HCO3-、AlO2-、HSO4- |
I.若A、B的水溶液均为无色,且A的水溶液呈强酸性,B的水溶液呈强碱性。混合后产生不溶于稀盐酸的白色沉淀及能使湿润的红色石蕊试纸变蓝色的气体。
(1)B的化学式为_____________。
(2)A、B溶液混合加热反应的离子方程式________________________。
Ⅱ.若A的水溶液呈浅绿色,B的水溶液无色且其焰色反应为黄色。向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合亦无明显变化。
(3)A的化学式为_____________。
(4)经分析上述过程中溶液变黄的原因可能有两种(用离子方程式表示)① ;② _ 。
(5)请用一简易方法证明上述溶液变黄的原因__________________________。
室温下,下列溶液中粒子浓度关系正确的是
| A.Na2S溶液:c(Na+) > c(HS-) > c(OH-) > c (H2S) |
| B.Na2C2O4溶液:c (OH-) = c(H+) + c(HC2O4-) + 2c (H2C2O4) |
| C.Na2CO3溶液:c (Na+) + c (H+) = 2c (CO32-)+ c (OH-) |
| D.CH3COONa和CaCl2混合溶液: c (Na+) + c (Ca2+)=c (CH3COO-) +c (CH3COOH) +2c (Cl-) |
从海水中制得的氯化钠除食用外,还可用作工业原料,生成多种含钠或氯的化工产品,利用CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl的反应原理可制备纯碱,下面是在实验室进行模拟实验的生产流程示意图:饱和食盐水溶液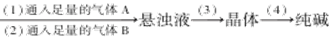
则相关的说法错误的是
| A.通入的气体:A是CO2,B是NH3 |
| B.NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3和NH4Cl的溶解度都小 |
| C.步骤(3)的操作为过滤,滤液可作化学肥料 |
| D.步骤(4)中,将晶体加热分解可以得到纯碱 |