从海水中制得的氯化钠除食用外,还可用作工业原料,生成多种含钠或氯的化工产品,利用CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl的反应原理可制备纯碱,下面是在实验室进行模拟实验的生产流程示意图:饱和食盐水溶液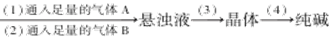
则相关的说法错误的是
| A.通入的气体:A是CO2,B是NH3 |
| B.NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3和NH4Cl的溶解度都小 |
| C.步骤(3)的操作为过滤,滤液可作化学肥料 |
| D.步骤(4)中,将晶体加热分解可以得到纯碱 |
在化学变化过程中,原子中的下列粒子数可能发生改变的是()
| A.质子数 | B.中子数 | C.质量数 | D.电子数 |
元素的性质呈周期性变化的根本原因是( )
| A.元素的原子半径呈周期性变化 |
| B.元素原子量的递增,量变引起质变 |
| C.元素的金属性和非金属性呈周期性变化 |
| D.元素原子的核外电子排布呈周期性变化 |
下列元素中,不属于主族元素的是()
| A.钡 | B.铁 | C.钙 | D.碘 |
KO2的晶体结构与NaCl相似,KO2可以看作是Na+的位置用K+代替,Cl-的位置用O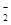 代替,则下列对于KO2晶体结构的描述正确的是
代替,则下列对于KO2晶体结构的描述正确的是
A.与K+距离相等且最近的O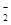 共有8个 共有8个 |
B.与K+距离相等且最近的O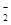 构成的多面体是正八面体 构成的多面体是正八面体 |
| C.与K+距离相等且最近的K+有8个 |
D.一个KO2晶胞中的K+和O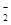 粒子数均为8个 粒子数均为8个 |
短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是
| A.元素W 的简单气态氢化物的热稳定性比X 的强 |
| B.元素W 的最高价氧化物对应水化物的酸性比Z 的弱 |
| C.化合物YX、ZX2、WX3中化学键的类型相同 |
| D.原子半径的大小顺序: r(Y)>r(Z)>r(W) >r(X) |