已知X、Y、Z为同一短周期的三种元素,其原子的部分电离能(kJ·mol-1)如下表所示:
| |
X |
Y |
Z |
| I1 |
496 |
738 |
578 |
| I2 |
4562 |
1451 |
1817 |
| I3 |
6912 |
7733 |
2745 |
| I4 |
9543 |
10540 |
11575 |
(1)三种元素电负性大小关系为 。
(2)写出Y原子的电子排布式 ,Y的第一电离能大于Z的第一电离能的原因 。
(3)X晶体采用下列 (填字母)堆积方式。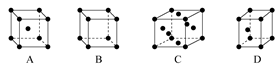
(4)含有元素X的盐的焰色反应为 色。许多金属盐都可以发生焰色反应,其原因是 。
(5)NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
| 晶体 |
NaCl |
KCl |
CaO |
| 晶格能/(kJ·mol-1) |
786 |
715 |
3401 |
4种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是 。
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向。
(1)已知:CH4(g) + 2O2(g)=CO2(g) + 2H2O(g) ΔH1= a kJ•mol-1
CO(g) + H2O (g)=CO2(g) + H2 (g) ΔH2= b kJ•mol-1
2CO(g) + O2(g)=2CO2(g) ΔH3 = c kJ•mol-1
反应CO2(g) + CH4(g) 2CO(g) + 2H2(g) 的ΔH=kJ•mol-1。
2CO(g) + 2H2(g) 的ΔH=kJ•mol-1。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
① 在不同温度下催化剂的催化效率与乙酸的生成速率如图8所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是。
② 为了提高该反应中CH4的转化率,可以采取的措施是。
③ 将Cu2Al2O4溶解在稀硝酸中的离子方程式为。
(3)以CO2为原料可以合成多种物质。
① 利用FeO吸收CO2的化学方程式为:6FeO + CO2=2Fe3O4 + C,则反应中每生成1molFe3O4,转移电子的物质的量为mol。
② 以氢氧化钾水溶液作电解质进行电解,在铜电极上CO2可转化为CH4,另一电极石墨连接电源的极,则该电解反应的化学方程式为。
已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
Ⅰ.还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:
有关离子完全沉淀的pH如下表:
| 有关离子 |
Fe2+ |
Fe3+ |
Cr3+ |
| 完全沉淀为对应氢氧化物的pH |
9.0 |
3.2 |
5.6 |
(1)写出Cr2O2- 7与FeSO4溶液在酸性条件下反应的离子方程式。
(2)还原+6价铬还可选用以下的试剂(填序号)。
A.明矾 B.亚硫酸氢钠C.生石灰D.铁屑
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
则在操作②中可用于调节溶液pH的试剂为:(填序号);
A.Na2O2B.Ba(OH)2C.Ca(OH)2D.NaOH
此时调节溶液的pH范围在(填序号)最佳。
A.3~4B.6~8C.10~11D.12~14
Ⅱ.电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O2- 7发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。
(4)写出阴极的电极反应式。
(5)电解法中加入氯化钠的作用是。
MMA既是一种高分子化合物(有机玻璃)的单体,又是制取甲基丙烯酸丙酯等的重要原料。现有三条制备高分子(MMA)的途径,其流程下如: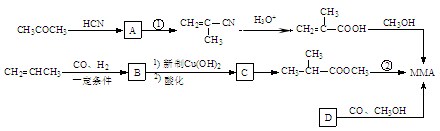
(1)工业上将A和甲醇及过量硫酸一起,一步反应生成MMA,该反应的化学方程式为。
(2)反应②是在500℃并有催化剂存在的条件下发生的,则其反应类型为:。
(3)某物质既能发生银镜反应,又能发生水解反应,其分子中还有手性碳原子,并与 互为同分异构体,则其物质结构简式为:。
互为同分异构体,则其物质结构简式为:。
(4)物质D的核磁共振氢谱有两个峰,它与CO、CH3OH以物质的量之比1︰1︰1反应恰好生成MMA, 则D的结构简式为,该方法的优点是。
(5)MMA和1‒丙醇反应制取甲基丙烯酸丙酯的化学方程式为:。
(6)根据题中流程里提供的新信息,写出由(CH3)2C=CH2制备化合物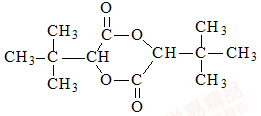
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下: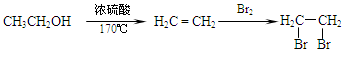
继侯德榜“联合制碱法”后,上世纪50年代某些化工专家开始研究有机胺制碱法,目前这项研究工作取得了一定进展。其工艺流程如下:
已知:NR3+ HC=NR3 •HCl,且NR3 •HCl易溶于有机溶剂。
(1)有机胺制碱法反应生成小苏打的化学方程式是:;操作①称为;
(2)过程③得到产品的化学方程式是:;
(3)在过程④中,回收有机胺的化学方程式是:;
(4)副产品的用途;
(5)本工艺流程中可循环利用的物质是:。
【化学一一选修5:有机化学基础】
有机物A~M有如图所示转化关系,A与F分子中所含碳原子数相同,且均能与NaHCO3溶液反应:F的分子式为C9H10O2,且不能使溴的CCl4溶液褪色;D能发生银镜反应:M与NaOH溶液反应后的产物,其一氯代物只有一种。
请回答:
(1)B、F的结构简式分别为:、。
(2)反应①~⑦中,属于消去反应的是:(填反应序号)。
(3)D发生银镜反应的化学方程式为:;反应⑦的化学方程式为:。
(4)A的相对分子质量在180—260之间,从以上转化中不能确认A中的某一官能团,确定该官能团的实验步骤和现象为:。
(5)写出符合下列条件F的所有同分异构体的结构简式。
a.能发生银镜反应
b.能与FeCl溶液发生显色反应
c.核磁共振氢谱上有四个峰,其峰面积之比为1:1:2:6