下列说法中正确的是( )
| A.离子晶体中每个离子的周围均吸引着6个带相反电荷的离子 |
| B.金属导电的原因是在外加电扬的作用下金属产生自由电子,电子定向运动 |
| C.分子晶体的熔沸点低,常温下均呈液态或气态 |
| D.原子晶体中的各相邻原子都以共价键相结合 |
反应A(g)+3B(g) = 2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )
A.v(A)=0.15 mol·L-1·min-1 B.v(B)=0.01 mol·L-1·s-1
C.v(C)=0.40 mol·L-1·min-1 D.v(D)=0.45 mol·L-1·min-1
类推的思维方法可解决不少化学问题,但类推的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中,你认为正确的是()
| A.沸点HBr>HCl,则同族元素氢化物沸点HCl>HF |
| B.Fe3O4可表示为FeO•Fe2O3,则Pb3O4可表示为PbO•Pb2O3 |
| C.CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应也只生成Na2SO3和O2 |
| D.因为N元素的非金属性比P元素强,所以HNO3的酸性强于H3PO4 |
设NA为阿伏加德罗常数的值,下列说法正确的是()
| A.lmolFeI2与足量氯气反应时转移的电子数为2NA |
| B.标准状况下,22.4LSO3含有NA个SO3分子 |
| C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA |
| D.56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
下列说法正确的是()
A.16O和18O的原子结构示意图均为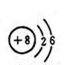 |
| B.在Na2O2和CaCl2中均含有共价键和离子键 |
C.结构示意图为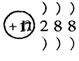 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 |
D.电子式 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 |
已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:H2O2 → H2O IO3- → I2 MnO4- → Mn2+ HNO3 → NO如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是:
| A.H2O2 | B.IO3- | C.MnO4- | D.HNO3 |