常温下用石墨作电极,电解100ml 0.1mol/L的硝酸铜和0.1mol/L的硝酸银组成的混合溶液,当阴极上生成的气体体积为0.112L时(标准状况),假设溶液体积不变,下列说法正确的是
| A.阳极上产生0.025mol的O2 |
| B.电解过程中总共转移0.2mol的电子 |
| C.所得溶液中的c(H+)=0.3mol/L |
| D.阴极增重1.08g |
用密度为ρ1 g/cm3,质量分数是ω的浓盐酸,配制成体积比为1∶4的稀盐酸,密度为ρ2g/cm3,则所配制稀盐酸的物质的量浓度为()
A.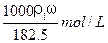 |
B. |
C. |
D. |
下列关于热化学反应的描述中正确的是()
| A.HCI和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH) 2反应的中和热△H=2×(-57.3)KJ/mol |
| B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的 △H=2×283.0kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
已知一定温度和压强下,合成氨反应:N2(g)+3H2(g) 2NH3(g);△H=-92.0KJ·mol-1,将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为α1,放出热量为Q1。若在相同条件下,起始时在该容器中充入2mol NH3,反应达到平衡时测得NH3的转化率为α2,吸收热量为Q2。下列说法错误的是()
2NH3(g);△H=-92.0KJ·mol-1,将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为α1,放出热量为Q1。若在相同条件下,起始时在该容器中充入2mol NH3,反应达到平衡时测得NH3的转化率为α2,吸收热量为Q2。下列说法错误的是()
| A.Q1 + Q2 = 92.0KJ | B.α1 + α2 = 1 |
| C.Q1 + Q2 = 184.0KJ | D.α1/α2 = Q1/ Q2 |
下列离子方程式中正确的是()
| A.铜与稀硝酸反应: Cu+2H++NO3-===Cu2++NO↑+H2O |
| B.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液: Fe2++2H++H2O2===Fe3++2H2O |
| C.过量的二氧化碳通入漂白粉溶液中: ClO-+CO2+H2O===HClO+HCO3- |
| D.AlCl3溶液中加入过量氨水: |
Al3++4NH3·H2O===AlO2-+2H2O+4NH4+
设NA为阿佛加德罗常数,下列叙述中不正确的是()
| A.46g NO2和N2O4混合气体中含有原子数为3NA |
| B.标准状况下22.4 L D2中含中子数为2NA |
| C.1L 1mol/L醋酸溶液中离子总数为2NA |
| D.1molMg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子 |