已知CO2、BF3、CH4、SO3都是非极性分子,NH3、H2S、H2O、SO2都是极性分子,由此可推知ABn型分子是非极性分子的经验规律是( )
| A.分子中所有原子在同一平面内 |
| B.分子中不含氢原子 |
| C.在ABn分子中,A元素为最高正价 |
| D.在ABn型分子中,A原子最外层电子都已成键 |
pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH
与溶液体积(V)的关系如图所示,下列结论正确的是
| A.相同温度下,x的的电离平衡常数小于y |
| B.若x、y是一元碱,等物质的量浓度的盐酸盐溶液,y的pH大 |
| C.若x、y都是弱碱,则a的值一定大于9 |
| D.完全中和x,y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y) |
高温下,某反应达到平衡,平衡常数K=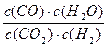 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
| A.该反应是焓变为正值 | B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 | D.该反应化学方程式为CO+H2O CO2+H2 CO2+H2 |
在一定温度下,向容积固定不变的密闭容器中充入a mol PCl5,发生如下反应:
PCl5(g)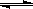 PCl3(g)+Cl2(g);达平衡后再向容器中充入amol PCl5,再次达到平衡后,与原平衡比较,下列叙述不正确的是
PCl3(g)+Cl2(g);达平衡后再向容器中充入amol PCl5,再次达到平衡后,与原平衡比较,下列叙述不正确的是
| A.混合气体的密度增大 | B.相对平均分子质量增大 |
| C.PCl5的转化率提高 | D.PCl5的质量分数增大 |
据报道,我国拥有完全自主产权的氢氧燃料电池车已在奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。下列有关电池的叙述不正确的是
| A.正极反应式为:O2+2H2O+4e-===4OH- |
| B.工作一段时间后,电解液中的KOH的物质的量不变 |
| C.电解质溶液中的OH-向负极移动 |
| D.用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.1mol电子转移 |
下列说法错误的是
| A.将pH=4的醋酸稀释后,溶液中所有离子的浓度均减小 |
| B.pH=11的某溶液中,水的电离可能促进也可能是抑制 |
| C.改变条件使醋酸的电离平衡向右移动,醋酸的电离度可能增大也可能减小 |
| D.改变条件使醋酸钠溶液中的醋酸根离子浓度增大,溶液的pH可能减小也可能增大 |