(1)图1为元素X的前五级电离能的数值示意图。已知X的原子序数<20,请写出X基态原子的核外电子排布式 。
(2)A、B、C、D、E、F、G、H八种短周期元素,其单质的沸点如图2所示。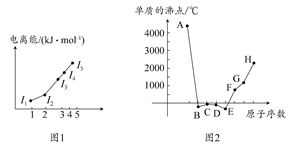
请回答:
①上述元素中,某些元素的常见单质所形成的晶体为分子晶体,这些单质分子中既含有σ键又含有π键的是 (填化学式)。
②已知D、F、G三种元素的离子具有跟E相同的电子层结构,则B、C、D三种元素的第一电离能由大到小的顺序为(用相关元素符号表示) 。
③已知H的电负性为1.5,而氯元素的电负性为3.0,二者形成的化合物极易水解,且易升华。据此推测该化合物的化学键类型为 。
④原子序数比A小1的元素与D元素形成的化合物的空间构型为 ,中心原子的杂化方式为 。
(每空2分,共16分)
A、B、C、D、E、X 都是短周期元素组成的常见无机物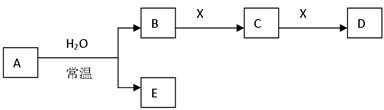
根据上框图关系,完成下列问题:
(1)A可作漂白剂,X是含有某种阳离子(此阳离子具有净水作用)的溶液,且M(A)=M(D),
则A与H2O反应的化学方程式为,C转化成D的离子方程式为
(2)A的 某种合金可作原子反应堆的导热剂,X是非极性分子的化合物,则A与H2O反应的离子方程式为,C转化成D的化学方程式为
某种合金可作原子反应堆的导热剂,X是非极性分子的化合物,则A与H2O反应的离子方程式为,C转化成D的化学方程式为
(3)A是单质,X是Na2CO3溶液,E可用消毒剂,则A与H2O反应的离子方程式为
,
(4)A是单质,X是单质(它的同素异形体是原子晶体),则E与SiO2反应的化学方程式为
(5)A是化合物,X是O2,C转化成D还需要催化剂,E具有两性,则A与H2O反应的化学方程式为
(6)A是化合物(Mr(A)=100),X是O2,B转化成C还需要催化剂,E是中强碱,则A
与H2O反应的化学方程式为
(每空3分,共15分)根据下框图关系,完成下列问题: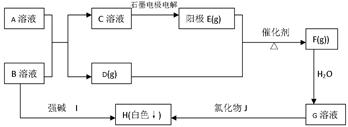
H(白色↓)不溶于盐酸,A、B都是酸式盐。
(1)工业生产D的典型设备是,工业生产F选择的条件是
(2)石墨电极电解C溶液时阳极的电极方程式是
(3)B溶液中加入I溶液反应恰好显中性时的离子方程式为
(4)B溶液与A溶液反应的离子方程式为
(每小题3分,共15分)
(1)实验室制取氯气反应的离子方程式为
(2)工业上制取漂白粉反应的化学方程式为
(3)配平:KClO3+H2C2O4+H2SO4 → K2SO4+ClO2↑+CO2↑+H2O
(4)二氧化碳气体通过一定量的过氧化钠固体,固体增重2.8g时,放出热量为Q KJ
则此反应的热化学方程式为
(5)标况下3.136 L Cl2通入0.1 L FeBr2溶液中,测得溶液Br-中消耗了三分之二,则此时总反应的离子方程式为
在密闭容器中,使2molN2和6molH2混合发生下列反应:
N2(g)+3H2(g)===2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时,N2和H2的浓度比是_______;N2和H2的转化率比是_________。
(2)升高平衡体系的温度(保持体积不变),混和气体的平均相对分子质量_______,密度________。(填“变大”、“变小”或“不变” )
(3)当达到平衡时,将C(N2)、C(H2)、C(NH3)同时减小一倍,平衡将向______移动。
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将向_________移动。
(5)若容器恒容,绝热、加热使容器内温度迅速升至原来的2倍,平衡将_______
(填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度_______(填“大于”“小于”或“等于”)原来的2倍。
在一定条件下反应2SO2(g)+O2(g)===2SO3(g)达到平衡状态的标志是_______________________________。
①某物质含量不变②某物质转化率不变③某物质浓度不变④恒容压强不变⑤恒压体积不变⑥ v(正)= v(逆)⑦条件一定,平均相对分子质量不变⑧体积一定,气体密度不变
上述条件符合:H2(g)+ I2(g)===2HI(g)反应达平衡的有_____________;上述条件符合:A(g)+B(l)===C(g)反应达平衡的有_____________________。