(11分) I:常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①、②、③的实验,实验数据记录如下表
| 序号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
| ① |
0.1 |
0.1 |
pH=9 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.2 |
0.1 |
pH<7 |
请回答:
(1)根据①组实验情况,分析混合溶液的pH=9的原因是 (用反应的离子方程式表示),在该溶液中下列关系式不正确的是(填序号字母)________。
A.c(Na+)+c(H+)=c(OH-)+c(A-)
B.c(Na+)=c(HA)+c(A-)
C.c(HA)+c(H+)=c(OH-)
D.c(Na+)+c(H+)=c(OH-)+c(A-)+c(HA)
(2)②组情况表明,c 0.2mol·L-1。混合溶液中离子浓度c(A-) c(Na+)(选填“>”、“<”或“=”)
(3)从③组实验结果分析,说明HA的电离程度 NaA的水解程度(选填“>”、“<”或“=”),离子浓度由大到小的顺序是__________________________。
Ⅱ:室温下,若将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示。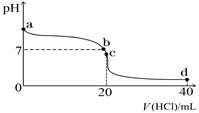
(1)NH3·H2O的电离方程式是 。
(2)b点所示溶液中的溶质是 。
(3)c点所示溶液中,离子浓度从大到小的关系为 。
2014年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是: 2CO2(g)+6H2(g)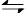 CH3OCH3(g)+3H2O(g) △H>0。
CH3OCH3(g)+3H2O(g) △H>0。
①写出该反应的平衡常数表达式。
②判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是。
| A.容器中密度不变 |
| B.单位时间内消耗2molCO2,同时消耗1mol二甲醚 |
| C.v(CO2)︰v(H2)=1︰3 |
| D.容器内压强保持不变 |
(2)汽车尾气净化的主要原理为:2NO(g)+2CO (g) 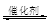 2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断: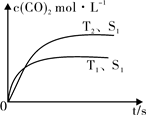
① 该反应的ΔH0(选填“>”、“<”)。
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在右图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(3)已知:CO(g)+2H2(g) CH3OH(g) rH =" -a" kJ•mol-1。
CH3OH(g) rH =" -a" kJ•mol-1。
①经测定不同温度下该反应的平衡常数如下:
| 温度(℃) |
250 |
300 |
350 |
| K |
2.041 |
0.270 |
0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)="0.4" mol·L-1、c(H2)="0.4" mol·L-1、c(CH3OH)="0.8" mol·L-1,则此时v正v逆(填“>”、“<”或“=”)。
②某温度下,在体积固定的2L的密闭容器中将1 mol CO和2 mol H2混合,测得不同时刻的反应前后压强关系如下:
| 时间(min) |
5 |
10 |
15 |
20 |
25 |
30 |
| 压强比(P后/P前) |
0.98 |
0.90 |
0.80 |
0.70 |
0.70 |
0.70 |
达到平衡时CO的转化率为。
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是。
(2)已知:①2Cu(s)+1/2O2(g)=Cu2O(s)△H = -akJ·mol-1
②C(s)+1/2O2(g)=CO(g)△H = -bkJ·mol-1
③Cu(s)+1/2O2(g)=CuO(s)△H = -ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g)△H =kJ·mol-1。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为。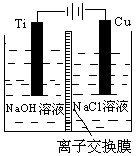
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为。已知肼与氨相似,则它与足量盐酸反应的方程式
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)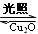 2H2(g)+ O2(g)△H>0 水蒸气的浓度随时间t变化如下表所示。
2H2(g)+ O2(g)△H>0 水蒸气的浓度随时间t变化如下表所示。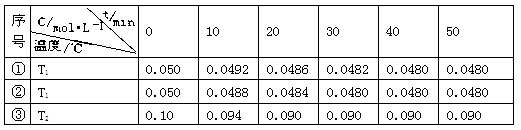
下列叙述正确的是(填字母代号)。
A.实验的温度:T2<T1
B.实验①前20 min的平均反应速率 v(O2)=7×10-5 mol·L-1 min-1
C.实验②比实验①所用的催化剂催化效率高
已知:硼镁矿主要成分为Mg2B2O5·H2O,硼砂的化学式为Na2B4O7·10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为: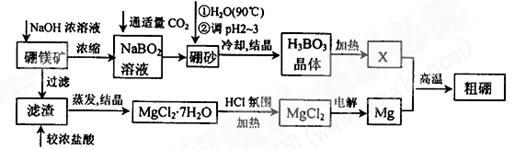
回答下列有关问题:
(1)硼砂中B的化合价为,将硼砂溶于热水后,常用稀H2SO4调pH=2~3制取H3BO3,该反应的离子方程式为。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是。若用惰性电极电解MgCl2溶液,其阴极反应式为。
(3)镁-H2O2酸性燃料电池的反应原理为 Mg+H2O2+2H+===Mg2++2H2O, 则正极反应式为。常温下,若起始电解质溶液pH=1,则当溶液pH=6时,(填“有”或“没有”)Mg(OH) 2沉淀析出。(已知Ksp[Mg(OH) 2]=5.6×10-12)。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.020 g粗硼制成的BI3完全分解,生成的I2用0.30 mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液18.00 mL。该粗硼样品的纯度为____(提示:I2+2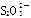 ===2I-+
===2I-+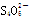 )(结果保留一位小数)。
)(结果保留一位小数)。
图是元素周期表的一部分,A、B、C、D、E、X是周期表给出元素组成的常见单质或化合物.已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)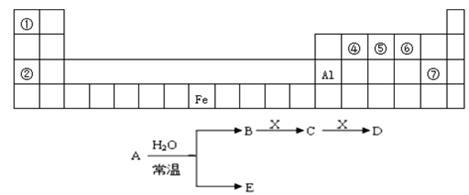
(1)若E为氧化物,则A与水反应的化学方程式为,该反应中氧化剂和还原剂的物质的量之比为.
①当X是碱性盐溶液,C分子中有22个电子时,表示X呈碱性的离子方程式为.
②当X为金属单质时,则X与B的稀溶液反应生成C的离子反应方程式为.
(2)若E为单质气体,D为白色沉淀,B含有的化学键类型为,C与X反应的离子方程式为.
(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,则该可逆反应的化学方程式为.
(12分)用所学的化学知识,回答下列问题:
(1)从海水中提取镁的主要步骤有:
①浓缩结晶(在HCl气流中)②加熟石灰③加盐酸④过滤⑤熔融电解,
请按照顺序写出正确的操作步骤(填序号):____________________
(2)化学方程式(未配平)As2S3 +H2O+NO3- = AsO43-+NO+ _______+SO42-,回答下面的问题:
A.反应后溶液显_____性(写酸、碱、中);B.每1mol水参加反应,该反应转移电子的数目为_______
(3)向过量的FeSO4溶液中加入几滴NaClO溶液,并且加入少量稀硫酸,发现溶液变成黄色。某同学认为该反应的还原产物有两种可能性,可能是Cl2或Cl-;而实验证明还原产物只存在Cl- 。回答下列问题:
A.还原产物中不存在氯气的原因是__________________________ (用化学用语表示)
B.写出上述过程的离子方程式____________________________________
C.为了检验上述反应是否生成了Cl-,请从下面选择合适的序号,并按照先后顺序排列,进行实验操作。则正确的操作顺序为__________________
A.取一支试管,加入上述反应后的溶液的少许;
B.加入过量的氯化钡溶液;
C.加入过量的硝酸钡溶液;
D.加入硝酸酸化的硝酸银溶液,观察到白色沉淀;
E.过滤,取滤液