城市的环境污染是当前突出的环境问题。如图A所示,X河流经某工业城市Y,其中a处在上游,附近有丰富的黄铁矿资源;d处在下游,附近有多个企业以硫酸为原料。根据某月Y市环保局监测站对X河水质检测的结果,绘制成简图如图B所示。下列说法不正确的是( )
| A.造成X河污染的主要污染源最可能分布在bc段 |
| B.工业生活污水、固体废弃物等可能是造成X河污染的污染源 |
| C.d处污染程度减小,可能是某些污染物的离子间发生反应生成沉淀所致 |
| D.该城市建设硫酸厂时,综合考虑诸多因素选址在b处最合理 |
能正确表示下列反应的离子方程式的是
| A.NaOH溶液中加入铝片:Al+2OH-=AlO2-+H2↑ |
B.NaHCO3溶液水解:HCO3-+H2O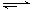 H3O+ +CO32- H3O+ +CO32- |
| C.NH4HCO3溶液与足量烧碱溶液混合:HCO3-+OH-=CO32-+H2O |
| D.硫酸溶液与氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
下列不属于有机物的是
| A.氯化钠 | B.醋酸 | C.乙炔 | D.尿素 |
12. 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)  Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。
下列判断正确的是
| A.往平衡体系中加入少量金属铅后,c(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应的△H>0 |
| D.25℃时,该反应的平衡常数K=2.2 |
一定条件下,等物质的量的N2和H2反应达平衡时,NH3的体积分数为40%,则下列叙述不正确的是
| A.N2的转化率为28.57% | B.H2的转化率为85.7% |
| C.N2的体积分数为20% | D.H2的体积分数为10% |
一定量的盐酸跟过量锌粉反应时,为了减缓反应速率但又不影响生成H2的总量,可采取的措施是
| A.加入少量NaOH固体 | B.加入少量CH3COONa固体 |
| C.加入少量NH4Cl固体 | D.加入少量Na2CO3固体 |