材料是人类生存和社会进步的物质基础,不同的材料功能各不相同。以下都是有关材料的内容,试根据所给内容回答问题。
(1)氢能是未来能源最佳选择之一,氢能的利用涉及氢的储存、输送和使用。贮氢合金是解决氢的储存等问题的重要材料。贮氢合金中最具代表性的是镧镍合金(LaNi5),已知LaNi5(s)+3H2(g)=LaNi5H6(g) ΔH=-31.77 kJ·mol-1。
镧镍合金的熔点比镧、镍的熔点 (填“高”、“低”或“介于两者之间”),根据反应原理,形成LaNi5H6的化学反应条件是 。最近有人提出可以研制出一种性能优越的催化剂,可以大大提高贮氢合金的贮氢能力,你认为该讲法可信吗? (填“可信”或“不可信”),其理由是 。
(2)无机非金属材料是日常生活中不可缺少的物质,它们往往具有高强度、耐高温、耐腐蚀的特点。Si3N4就是一种重要的精细陶瓷,合成氮化硅的方法之一为:3SiO2+6C+2N2 Si3N4+6CO。Si3N4属于 晶体,在上述反应中氧化剂为 。
Si3N4+6CO。Si3N4属于 晶体,在上述反应中氧化剂为 。
(3)有机高分子材料形式多样,ABS树脂广泛用于制造电讯器材、汽车、飞机零部件和各种仪器的外壳,它的结构可以表示为
试写出对应单体的结构简式CH2=CH—CN、 、 。
(4)高分子吸水树脂可以由聚乙烯醇(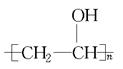 )和聚丙烯酸盐(
)和聚丙烯酸盐( )交联得到,从结构上看该高分子吸水材料具有吸水性,原因为它们都具有 基团。
)交联得到,从结构上看该高分子吸水材料具有吸水性,原因为它们都具有 基团。
某一反应体系有反应物和生成物五种物质: O2 H2CrO4 Cr(OH)3 H2O H2O2
已知该反应中H2O2只发生如下过程H2O2→O2
(1)该反应中的还原剂是________________________。
(2)该反应中,发生还原反应的过程是_____________→_____________。
(3)如反应转移了0.3 mol电子,则产生的气体在标准状况下体积为_____________。
有一固体,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl中的一种或几种组成。为鉴别它们,做了如下实验:
①将固体混合物溶于水,搅拌后得无色溶液;
②在此溶液中滴入BaCl2溶液,有白色沉淀生成;
③过滤,然后在此白色沉淀中加入足量稀硝酸,沉淀最后全部消失。
由此推断:固体中肯定有,肯定没有,可能会有。如果进一步确定可能会有的物质是否存在,可采用的检验方法是
(9分) 选用一种试剂除去下列各物质中的杂质(括号内为杂质),把所选试剂的化学式填在横线上,并写出离子方程式。
(1)BaCl2(HCl)试剂;离子方程式为
(2)CO(CO2)试剂;离子方程式为
(3)Fe SO4 (Cu SO4);离子方程式为
现有以下物质 ①NaCl晶体 ②液态HCl ③CaCO3固体 ④熔融KCl
⑤蔗糖 ⑥铜 ⑦CO2 ⑧稀H2SO4溶液 ⑨KOH固体(填序号)
(1)以上物质中能导电的是
(2)以上物质中属于电解质的是
(3) 以上物质中,属于盐的是
(1)将质量比为14︰15的N2和NO混合,则混合气体中N2和NO的物质的量之比为,氮原子和氧原子的个数比为。
(2) 5molCO2在标准状况下所占的体积约为;所含氧原子的数目约为。
(3)12.4 g Na2X中含有0.4 mol Na+,则Na2X的摩尔质量是,该物质的化学式为。
(4)在mL 0.2 mol/L NaOH溶液中含1 g溶质;配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2Og。